Hoofdstuk 3
Experimenteren
§1 Veiligheid §2 Experimenteren §3 Chemische reacties en faseovergangen §4 Verbranding §5 Zuren en basen §6 Schoonmaken
§1 Veiligheid
In de scheikunde werken we vaak met chemicaliën. Voordat we gaan experimenteren met deze stoffen is het van belang dat je hier veilig mee om kan gaan. In deze paragraaf lees je hier meer over.
Ter bescherming van je kleding en je armen dragen we tijdens scheikunde-experimenten een labjas en ter bescherming van je ogen draag je een veiligheidsbril (zie de onderstaande afbeelding). Beide dien je ten alle tijden op te hebben als er in het lokaal scheikunde-experimenten worden uitgevoerd. Denk er tevens aan om lange haren met een elastiek in een knotje te binden. Je wilt immers niet dat je haren in een gevaarlijke stof of in een vlam belanden. Let er ook op dat je niet eet en drinkt in het scheikundelokaal, omdat stoffen via je handen in je eten kunnen gaan zitten. Om gevaarlijke stoffen niet onopgemerkt via je handen mee naar buiten te nemen, is het van belang je handen te wassen na afloop van een experiment.
Let er tevens op dat je veel stoffen die je gebruikt in de scheikundeles niet in de prullenbak of de gootsteen kan gooien. Dit geldt bijvoorbeeld voor stoffen die giftig zijn of schadelijk zijn voor het milieu. Vaak worden deze stoffen verzameld in een speciaal afvalvat in het lokaal.
Mocht er toch iets misgaan tijdens een experiment, dan zijn er in het lokaal een aantal hulpmiddelen aanwezig. Als je een stof in je ogen krijgt, spoel je ogen dan zo snel mogelijk schoon met de oogdouche. Als je kleding in brand vliegt, ga dan onder de douche staan. Als er in het lokaal een brand ontstaat, dan kan je gebruik maken van de branddeken of de brandblusser. Gelukkig zijn deze noodmaatregelen zelden tot nooit nodig, maar mocht het een keer misgaan, dan is het belangrijk dat je weet wat je in zo’n situatie moet doen.
 (Afbeelding: TEDxNewcastle met Andrew Szydlo)
(Afbeelding: TEDxNewcastle met Andrew Szydlo)
Bij het gebruik van stoffen is het van belang eerst op het etiket te kijken, zodat je weet waar je op moet letten bij het gebruik van de stof. Op het etiket staan namelijk zogenaamde gevarenpictogrammen. Hieronder zie je een aantal pictogrammen waarvan je de betekenis uit je hoofd moet kennen. De pictogrammen staan ook in BINAS. In de onderstaande tabel zijn een aantal pictogrammen toegelicht.

|
Pictogram |
Betekenis |
|
Onder druk |
Een fles kan exploderen of de dop kan er hard afschieten als de fles te warm wordt. |
|
Schadelijk |
Deze stof is irriterend of schadelijk voor de huid en ogen of bij het inademen of inslikken. |
|
Corrosief |
Deze stof reageert bijtend op de huid en kan ook bepaalde materialen aantasten. |
|
Langetermijn-schade |
De schade bij deze stoffen is niet direct merkbaar, maar wel op lange termijn. Denk bijvoorbeeld aan kankerverwekkende stoffen. |
|
Ontvlambaar |
Deze stof kan gemakkelijk ontbranden. |
|
Oxiderend |
Deze stof kan andere stoffen gemakkelijk laten ontbranden of kan verbranding heftiger maken. |
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§2 Experimenteren
In deze paragraaf komen we dan eindelijk toe aan het uitvoeren van experimenten. In de theorie bespreken we een aantal materialen die we gebruiken bij experimenteren.
Als we stoffen willen mengen of verwarmen, dan doen we deze stoffen vaak eerst in glaswerk. Een bekend voorbeeld is de reageerbuis. Dit is een lang, dun, glazen buisje dat wordt gebruikt als we werken met kleine hoeveelheden stof (zie de onderstaande afbeeldingen). Door de onderkant van een reageerbuis rustig heen en weer te schudden (te kwispelen) kan je de stoffen die erin zitten voorzichtig mengen. Als harder schudden nodig is, kan je de reageerbuis dichtmaken met een rubberen stop (zie de rechter afbeelding). Met een reageerbuisknijper kan de reageerbuis opgepakt worden en in een vlam verhit worden.
 (Afbeelding: Alvy16; CC BY 4.0 )
(Afbeelding: Alvy16; CC BY 4.0 )
Een type glaswerk waar we meer stof in kwijt kunnen is het bekerglas (zie de eerste onderstaande afbeelding). Daarnaast hebben we ook de erlenmeyer (zie de tweede afbeelding). Een erlenmeyer heeft een brede bodem en een smalle hals en als gevolg kan je dit type glaswerk gemakkelijk schudden zonder te morsen. Zowel het bekerglas als de erlenmeyer kunnen ook verwarmd worden met een brander. Ze worden hiervoor eerst op een driepoot gezet (zie de derde afbeelding). Een ander type glaswerk is de maatcilinder (zie de vierde afbeelding). Een maatcilinder is een lange cilinder met op de zijkant een maatverdeling waarmee we het volume van vloeistoffen kunnen bepalen. Meestal wordt de maatverdeling gegeven in milliliters. Maatcilinders zijn niet bedoeld om te verwarmen.
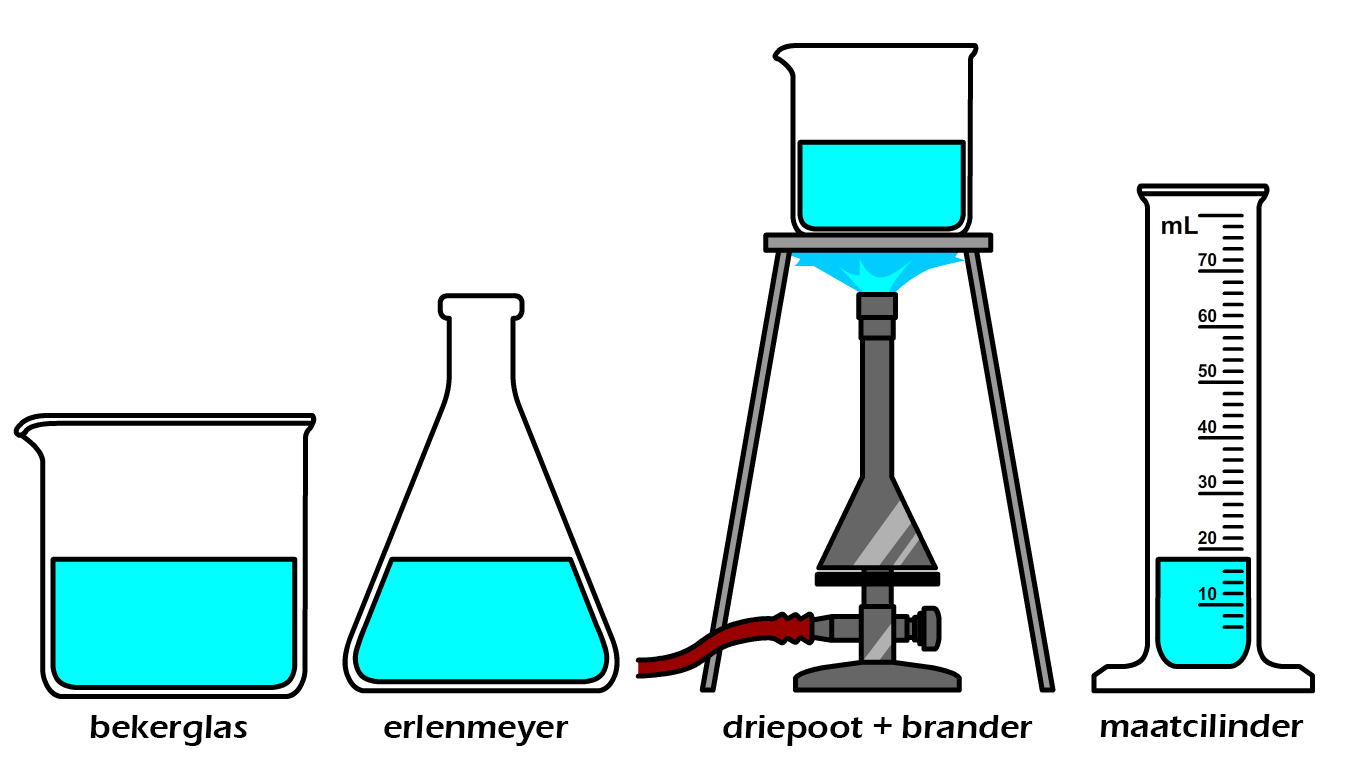
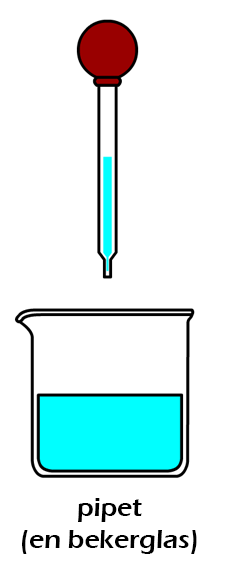
Hieronder zien we een pipet. Dit is een klein glazen buisje met aan de bovenkant een rubberen ballonnetje. Als je de pipet in een vloeistof houdt en dan knijpt in het ballonnetje, dan vult de pipet zich met een beetje vloeistof. Deze vloeistof kan je dan op een andere plek weer loslaten.
Om stoffen te verwarmen gebruiken we een gasbrander (zie de onderstaande afbeelding). De branders in het scheikundelokaal werken op aardgas. Dit gas bestaat voornamelijk uit het brandbare methaan (CH4). Dit gas is kleurloos en geurloos en daarom niet door mensen te detecteren. Omdat het gevaarlijk kan zijn als dit gas in een afgesloten ruimte ontsnapt, is een geur toegevoegd, zodat we het aardgas direct kunnen herkennen. Als we het aardgas met een lucifer aansteken, dan reageert het gas met de zuurstof in de lucht. Bij deze reactie komt warmte en licht vrij—er ontstaat vuur.
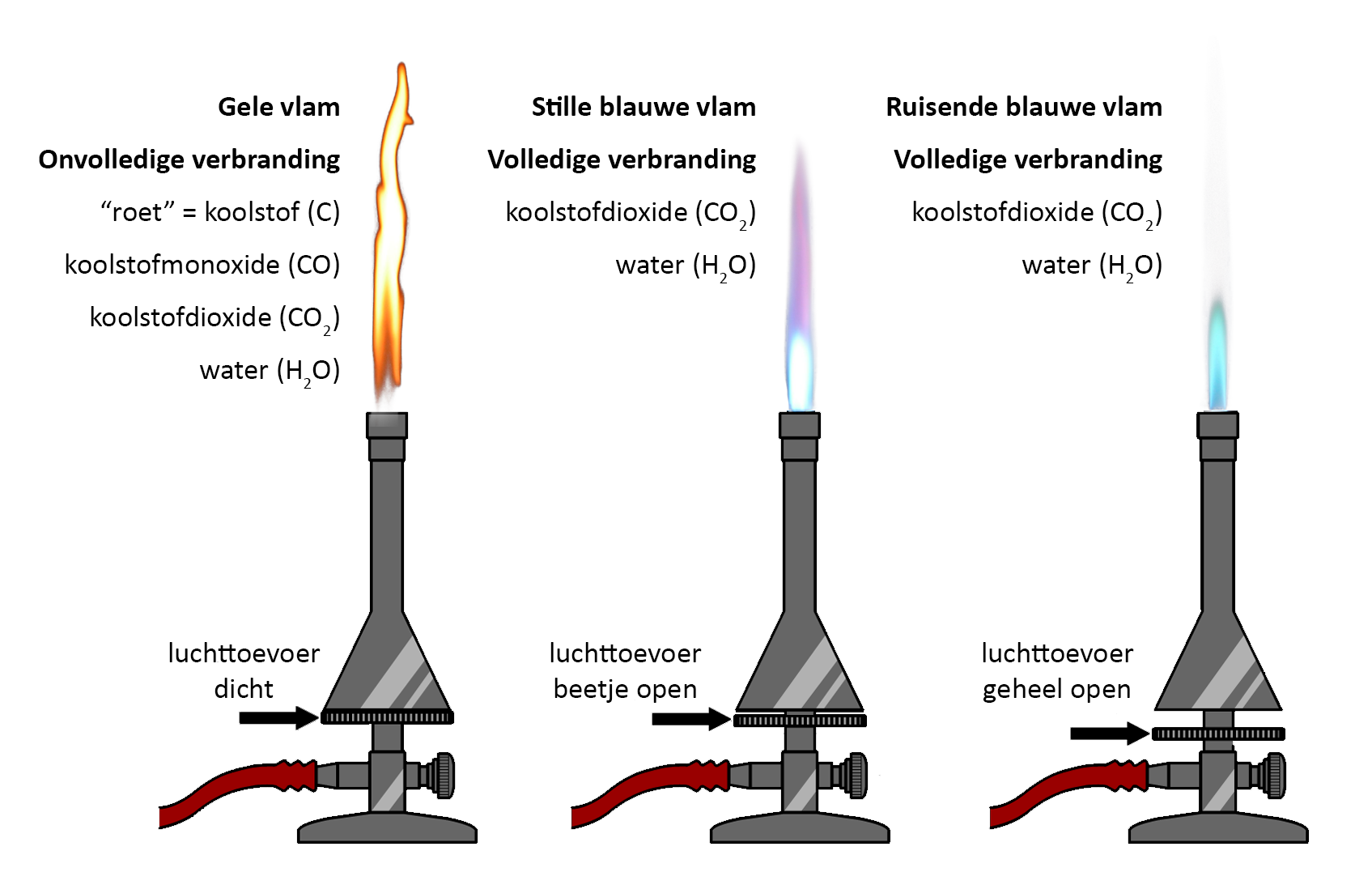
Als je met de gasbrander wilt werken, zorg je eerst dat de twee draaiknoppen van de brander dicht zijn. De onderste knop regelt de gastoevoer. Draai deze knop een beetje open en steek het gas met een lucifer aan. Als het goed is krijg je nu een gele vlam te zien. Door de gastoevoer nog verder open te draaien wordt de vlam groter.
De bovenste knop regelt de luchttoevoer. Op dit moment is deze knop nog dicht en als gevolg kan er maar weinig zuurstof bij de vlam komen. We spreken in dit geval van onvolledige verbranding. Bij dit type verbranding komt naast water (H2O) en koolstofdioxide (CO2) ook koolstof (C) en koolstofmonoxide (CO) vrij. Koolstofmonoxide is een onzichtbaar gas dat bij hoge concentratie gevaarlijk is voor de mens en zelfs dodelijk kan zijn. Dit is waarom veel mensen in huis een koolstofmonoxidemelder hebben hangen. Koolstof is een zwarte vaste stof die we in het dagelijks leven "roet" noemen. Het ontstaan van roet merken we bijvoorbeeld als we een stukje glas in de gele vlam houden (zie de onderstaande afbeelding). Omdat we geen roet op ons glaswerk willen hebben, wordt een gele vlam niet gebruikt voor het verwarmen van materialen. Als we de brander even niet gebruiken, gebruiken we wel de gele vlam, omdat deze vlam het best zichtbaar is. De gele vlam wordt daarom ook wel de waarschuwingsvlam genoemd.
 (Afbeelding: ... / Arthur Jan Fijalkowski; CC BY 3.0)
(Afbeelding: ... / Arthur Jan Fijalkowski; CC BY 3.0)
Als we stoffen willen verwarmen, dan zetten we de luchttoevoer verder open. Als we dit geleidelijk doen, zullen we eerst zien dat de vlam blauw wordt. Bij grote hoeveelheden zuurstof gaat de vlam daarnaast ook hoorbaar ruisen en wordt er een lichtblauwe kern in de vlam zichtbaar. We noemen deze vlammen de stille blauwe vlam en de ruisende blauwe vlam. De drie vlammen kan je in de onderstaande linker afbeelding zien. Hoe meer we de luchttoevoer openzetten, hoe heter de vlam wordt. Het topje van de lichtblauwe kern is het heetste deel van de vlam en daar worden dan ook materialen gehouden die we sterk willen verhitten.
Bij de blauwe vlam en de ruisende vlam vindt volledige verbranding plaats. Bij dit type verbranding ontstaat alleen koolstofdioxide (CO2) en waterdamp (H2O).
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§3 Chemische reacties en faseovergangen
In deze paragraaf gaan we het verschil tussen chemische reacties en natuurkundige processen bestuderen.
Scheikunde gaat over de eigenschappen van stoffen en wat er gebeurt als we deze stoffen mengen. In sommige omstandigheden kunnen stoffen veranderen in compleet andere stoffen. Als dit gebeurt, spreken we van een chemische reactie. Bijvoorbeeld een kleurverandering of een verbranding is een aanwijzing dat er een chemische reactie heeft plaatsgevonden.
Een bekend voorbeeld van een chemische reactie is de verbrandingsreactie. In de linker onderstaande afbeelding zien we de verbranding van staalwol. Staalwol bestaat voornamelijk uit ijzer en bij hoge temperaturen reageert het met de zuurstof in de lucht. Dit gebeurt bijvoorbeeld als je een batterij tegen staalwol aanhoudt. Bij de verbranding van ijzer ontstaat ijzeroxide. In het dagelijks leven noemen we dit ook wel "roest". Bij deze reactie is zuurstof en ijzer dus veranderd in een nieuwe stof: ijzeroxide. Er heeft dus een chemische reactie plaatsgevonden. In de natuur roest ijzer ook, maar dat gaat veel langzamer (zie de rechter afbeelding).

 (Afbeelding: alennzg / Islander61; CC BY-SA 4.0)
(Afbeelding: alennzg / Islander61; CC BY-SA 4.0)
Het is belangrijk chemische reacties te kunnen onderscheiden van natuurkundige processen. Bij een natuurkundig proces verandert een stof, maar er ontstaat geen nieuwe stof en er is dan dus ook geen sprake van een chemische reactie. Een voorbeeld hiervan zijn faseovergangen. Denk bijvoorbeeld aan het smelten van ijs of het koken van water. Of je water nu in gas-, vloeibare- of vaste vorm tegenkomt, het blijft water. . Bij een faseovergang ontstaat dus geen nieuwe stof en daarom is een faseovergang geen chemische reactie, maar een natuurkundig proces.
Een ander voorbeeld is het uitzetten of krimpen van een gas door dit gas te verwarmen of af te koelen. Als we bijvoorbeeld een ballon in extreem koud vloeibaar stikstof duwen, dan wordt het gas kouder en daardoor krimpt de ballon (zie hoofdstuk “Temperatuur”). Dit is ook een voorbeeld van een natuurkundig proces, want er ontstaan bij deze verandering geen nieuwe stoffen.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§4 Verbranding
In deze paragraaf gaan we bestuderen welke factoren nodig zijn voor verbranding.
Brand kunnen we herkennen aan vijf verbrandingsverschijnselen:
- Vlammen bestaan uit gloeiend gas (zie de linker onderstaande afbeelding).
- Roet is de zwarte stof genaamd koolstof (zie de tweede afbeelding).
- Rook bestaat uit zwevende vaste roetdeeltjes (zie de derde afbeelding).
- Vonken zijn kleine gloeiende deeltjes die wegschieten van een brandstof (zie de vierde afbeelding).
- Bij verbranding komt ook altijd warmte vrij, dit is een vorm van energie.

Een stof vliegt in brand als aan drie voorwaarden wordt voldaan. De eerste factor is de aanwezigheid van een brandstof, de tweede factor is de aanwezigheid van genoeg zuurstof en de derde factor is een temperatuur boven de ontbrandingstemperatuur. Deze drie voorwaarden zijn samengevat in de onderstaande verbrandingsdriehoek.

Misschien had je naast deze drie factoren ook verwacht dat het noodzakelijk zou zijn dat de brandstof "aangestoken" wordt. Dit is echter niet noodzakelijk. Als aan de bovenstaande drie eisen wordt voldaan, dan vliegt de stof automatisch in brand (dit zie je bijvoorbeeld gebeuren in het onderstaande filmpje). De vlam van een lucifer kan natuurlijk wel helpen om de ontbrandingstemperatuur te bereiken.
 EXPERIMENT
EXPERIMENT
| ||
|
Als we een brand willen blussen, dan kan dat door één of meerdere van de drie factoren weg te nemen. Als bijvoorbeeld olijfolie in een koekenpan in brand vliegt, dan is het voldoende om een deksel op de pan te plaatsen. Als gevolg raakt de zuurstof in de pan op en stopt de verbrandingsreactie (het is geen goed idee om water in een pan te gooien, want dan ontstaat een gevaarlijke steekvlam doordat hete oliedruppels opspatten). De brandweer gebruikt vaak water om vuur te doven. Water helpt bij het blussen van een brand omdat het de brandstof afkoelt. Het zorgt ervoor dat de temperatuur van de brandstof onder de ontbrandingstemperatuur komt. Een andere mogelijkheid om een brand te blussen is met een CO2-brandblusser. De koolstofdioxide in de blusser duwt de zuurstof in de lucht weg bij het vuur en daardoor gaat het vuur uit. We zien dit effect in het onderstaande filmpje.
 EXPERIMENT
EXPERIMENT
| ||
|
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
| ||||||||||
|
§5 Zuren en basen
In deze paragraaf introduceren we zuren, basen en pH-neutrale stoffen.
In het dagelijks leven komen we veel zuren tegen. Citroensap en azijn worden bijvoorbeeld geregeld gebruikt in maaltijden. Zoutzuur is het zuur waarmee eten verteerd wordt in je maag. Basische stoffen ken je ook. Zeep is een voorbeeld van een basische stof. Je hebt zeep vast wel eens per ongeluk geproefd. De zeepsmaak is kenmerkend voor veel basische stoffen.

Hoe zuur of hoe basisch een stof is geven we aan met een getal genaamd de zuurgraad, ook wel de pH-waarde genoemd. Er geldt:
- Een zuur heeft een pH onder de 7. Hoe lager de pH, hoe zuurder de stof.
- Basen hebben een pH-waarde van boven de 7. Hoe hoger de pH, hoe meer basisch de stof.
- Stoffen met een pH van 7 noemen we pH-neutraal. Deze stoffen zijn niet zuur en niet basisch. Het bekendste voorbeeld hiervan is water.
We kunnen de zuurgraad van een stof bepalen met behulp van een indicator. Een bekend voorbeeld hiervan is rodekoolsap. Hieronder is rodekoolsap toegevoegd aan een aantal stoffen met toenemende pH-waarde van links naar rechts. Met behulp van een chemische reactie verkleurt de sap afhankelijk van de pH-waarde. Rodekoolsap wordt rood in erg zure stoffen en geel in erg basische stoffen.
 (Afbeelding; Epaenurk; CC BY-SA 3.0)
(Afbeelding; Epaenurk; CC BY-SA 3.0)
Een erg nauwkeurige manier om de pH-waarde te bepalen is met universeel indicatorpapier. Als je een stof in aanraking brengt met dit papier, dan verkleurt het. Bij een rolletje indicatorpapier is een legenda afgebeeld waarop je kan zien welke pH-waarde hoort bij welke kleur (zie de onderstaande afbeelding).
 (Afbeelding: AGeremia CC BY-SA 4.0)
(Afbeelding: AGeremia CC BY-SA 4.0)
Hieronder zien we een aantal stoffen met de bijbehorende pH-waarde en de kleur van het universeel indicatorpapier:
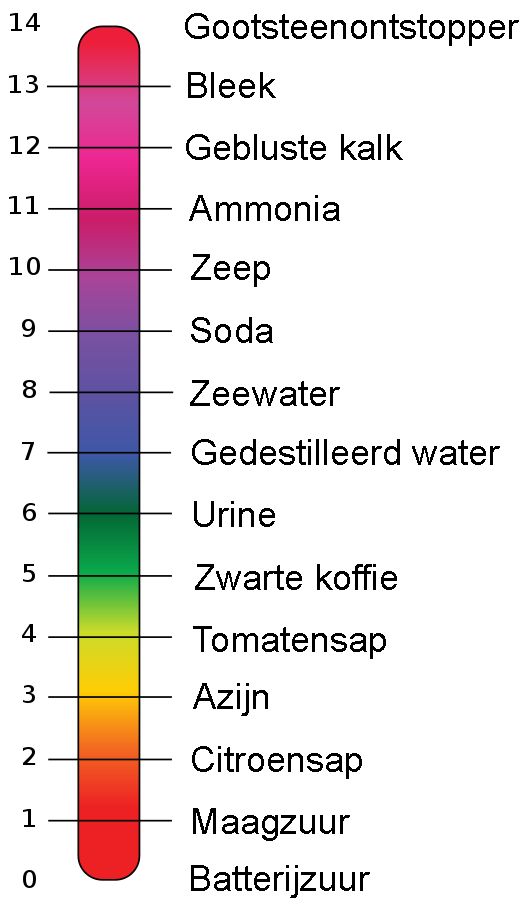 (Afbeelding: Edward Stevens; CC BY 3.0-mod)
(Afbeelding: Edward Stevens; CC BY 3.0-mod)
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§6 Schoonmaken
In het dagelijks leven komen we scheikunde vaak tegen bij het schoonmaken. Vaak zijn schoonmaakmiddelen zuren of basen. In deze paragraaf gaan we hierover leren.
Zoals je weet zijn sommige vlekken gewoon met water uit je kleding te wassen en andere niet. De vlekken die we wel met water wegkrijgen hebben de eigenschap dat ze oplossen in water. Een goed voorbeeld hiervan zijn de suikers in zoete drankjes, zoals limonade.
Bij vetvlekken is water niet voldoende. Vet lost niet op in water en vet kan je ook niet wegspoelen met water. We kunnen deze vlekken wel verwijderen met zeep. Zeepdeeltjes hebben een kop en een steel. De steeltjes kunnen niet oplossen in water en komen na verloop van tijd vast te zitten in het vet (zie de onderstaande afbeelding). De koppen komen aan de buitenkant van het vet te zitten en zijn wel oplosbaar in water. Als gevolg kan het vet nu oplossen in water en daarna kan het water worden weggespoeld.
 (Afbeelding: AGeremia CC BY-SA 4.0)
(Afbeelding: AGeremia CC BY-SA 4.0)
Zoals je weet gebruiken we zeep ook om de huid schoon te maken. Dit werkt erg goed, maar het heeft ook nadelen. Er zit namelijk een vettig talglaagje op de huid dat zorgt dat de huid niet uitdroogt. Dit laagje wordt door zeep verwijderd. Vaak wassen kan daarom uitdroging van de huid veroorzaken.
Naast zeep wordt ook soda gebruikt om vetten te verwijderen. Net als zeep, is ook soda een basische stof. Voor vetten die zelfs met zeep en soda niet oplossen, kan een sterkere basische stof gebruikt worden, bijvoorbeeld gootsteenontstopper of ammonia.
Een ander voorbeeld van een stof die niet oplost in water is nagellak. Om nagellak op te lossen wordt vaak aceton gebruikt. Om verf op te lossen gebruiken we vaak terpentine of wasbenzine.
Een ander type vuil waar we in huis graag vanaf willen is kalkaanslag, ook wel ketelsteen genoemd. Kalk zit opgelost in water en als water verdampt, blijft kalkaanslag achter. Dit kan je bijvoorbeeld zien als je een pan water laat droogkoken. Er blijft dan een duidelijk zichtbaar laagje kalkaanslag achter. We zien dit ook vaak in de badkamer op plekken waar veel water verdampt, zoals bij een kraan (zie de onderstaande linker afbeelding). Een andere plek waar we kalk tegenkomen is bijvoorbeeld op het warmte-element in een waterkoker of wasmachine (zie de rechter onderstaande afbeelding). Omdat kalk warmte slecht geleid maakt dit de wasmachine op den duur minder efficiënt.

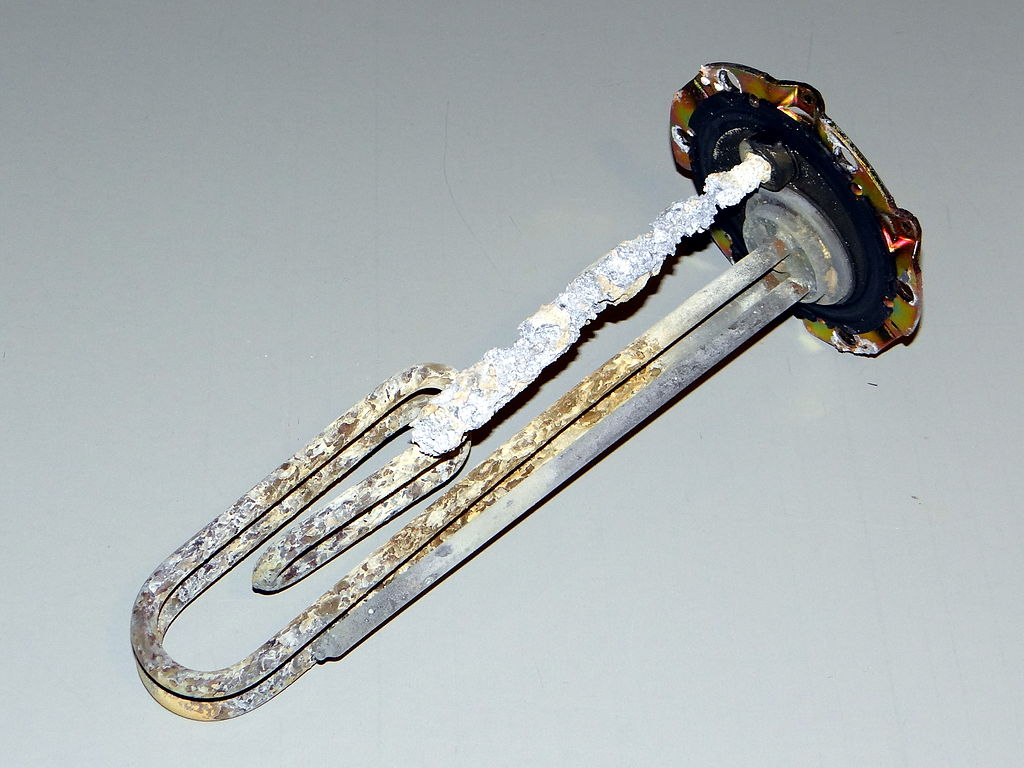 (Zbigniew Czernik; CC BY 3.0 / Hustvedt; CC BY-SA 3.0)
(Zbigniew Czernik; CC BY 3.0 / Hustvedt; CC BY-SA 3.0)
Kalkaanslag kunnen we goed verwijderen met zuren. Een goed voorbeeld is schoonmaakazijn. Hieronder is bijvoorbeeld azijn gebruikt bij het verwijderen van kalk van het verwarmingselement van een waterkoker.

Als laatste bespreken we schuurmiddel. Hierin zitten fijne korreltjes vaste stof die een schurende werking hebben. Een voorbeeld is garagezeep, dat gebruikt wordt in garages en werkplaatsen om hardnekkige olie- en vetvlekken te verwijderen. Een ander voorbeeld is tandpasta, waarin krijt zit dat fungeert als een licht schuurmiddel om je tanden schoon te krijgen.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
OUDE VERSIE (2024-2025) NIEUW 2025 - (2p) Als je onder de douche staat, dan spoelt zweet van je lichaam weg, maar niet talg. Leg dit uit. NIEUW 2025 - (3p) Een leerling maakt op zijn shirt vlekken van honing, mayonaise en limonadesiroop. Welke van deze vlekken kan je met water schoonkrijgen? En hoe krijg je de vlekken schoon die je niet met water schoon krijgt? NIEUWE VERSIE (2025-2026) |
| BINAS: | |
| 31 | Pictogrammen |
| 36 | Zuur-base-indicatoren |