Hoofdstuk 7
Zuren en basen
§1 Zuren en basen §2 Schoonmaken §3 Zuren en basen II §4 Zuur-basereacties §5 Titreren
§1 Zuren en basen
In deze paragraaf introduceren we zuren, basen en pH-neutrale stoffen.
In het dagelijks leven komen we veel zuren tegen. Citroensap en azijn worden bijvoorbeeld geregeld gebruikt in maaltijden. Zoutzuur is het zuur waarmee eten verteerd wordt in je maag. Basische stoffen ken je ook, alhoewel het woord misschien nieuw voor je is. Zeep is een voorbeeld van een basische stof. Je hebt zeep vast wel eens per ongeluk geproefd. De zeepsmaak is kenmerkend voor veel basische stoffen.

Hoe zuur of hoe basisch een stof is geven we aan met een getal genaamd de zuurgraad, ook wel de pH-waarde genoemd. Een zuur heeft een pH onder de 7. Hoe lager de pH, hoe zuurder de stof. Basen hebben een pH waarde van boven de 7. Hier geldt dat hoe hoger de pH, hoe meer basisch de stof is. Stofen met een pH van 7 noemen we pH-neutraal. Deze stoffen zijn niet zuur en niet basisch. Het bekendste voorbeeld hiervan is water.
We kunnen de zuurgraad van een stof te vinden met behulp van een indicator. Een bekend voorbeeld hiervan is rodekoolsap. Hieronder is rodekoolsap toegevoegd aan een aantal stoffen met toenemende pH-waarde van links naar rechts. Met behulp van een chemische reactie verkleurt de sap afhankelijk van de pH-waarde. Rodekoolsap wordt rood in erg zure stoffen en geel in erg basische stofen.
 (Afbeelding; Epaenurk; CC BY-SA 3.0)
(Afbeelding; Epaenurk; CC BY-SA 3.0)
Andere voorbeelden van indicatoren zijn lakmoes en fenolftaleïne. Lakmoes wordt vaak aangebracht op een dun strookje papier. Een druppel van een zuur op dit papier maakt het rood en een druppel van een base maakt het blauw. Fenolftaleïne blijft kleurloos in een zuur en wordt paars in een basische stof. Het is niet nodig dit uit je hoofd te weten, want voor een heel aantal andere indicatoren zijn de kleurovergangen te vinden in BINAS.
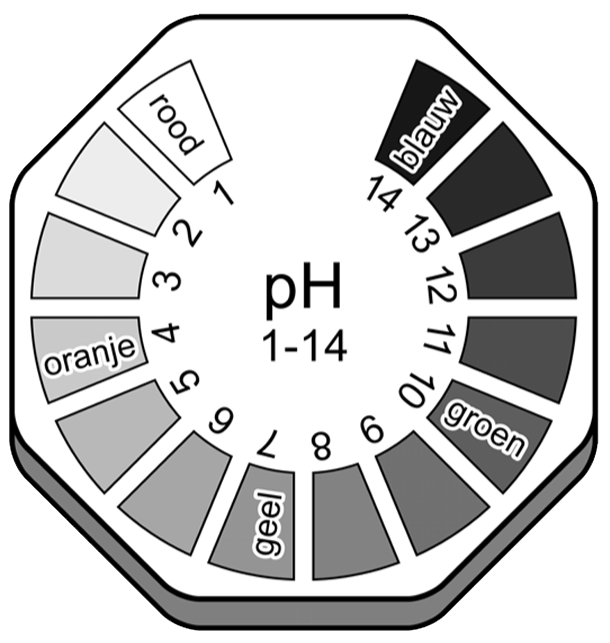
Een erg nauwkeurige manier om de pH-waarde te bepalen is met universeel indicatorpapier. Als je een stof in aanraking brengt met dit papier, dan verkleurt het. Bij een rolletje indicatorpapier is een legenda afgebeeld waarop je kan zien welke pH-waarde hoort bij welke kleur (zie de onderstaande afbeelding).
 (Afbeelding: AGeremia CC BY-SA 4.0)
(Afbeelding: AGeremia CC BY-SA 4.0)
Hieronder zien we een aantal stoffen met de bijbehorende pH-waarde en de kleur van het universeel indictatorpapier:
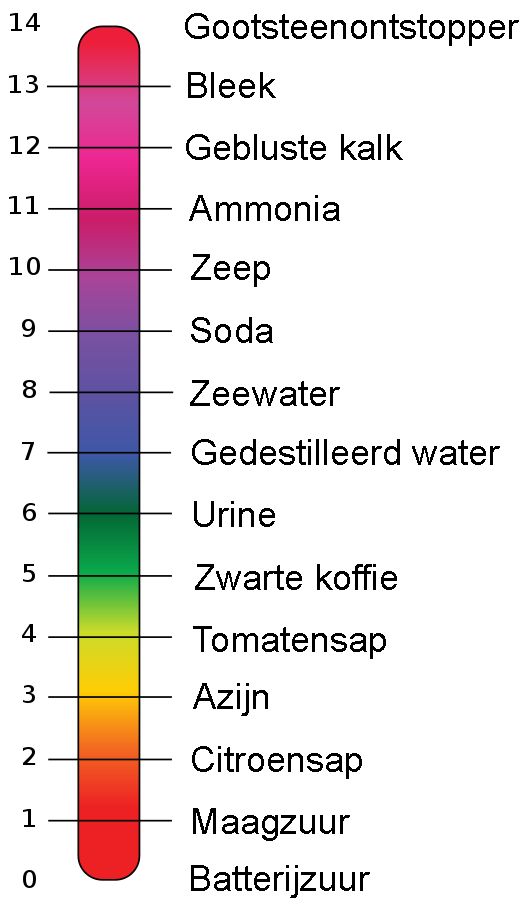 (Afbeelding: Edward Stevens; CC BY 3.0-mod)
(Afbeelding: Edward Stevens; CC BY 3.0-mod)
In de onderstaande tabel is een aantal zuren en basen te vinden die je uit je hoofd moet kennen:
| Zuur | Base | ||
| Triviale naam | Chemische formule | Triviale naam | Chemische formule |
| Zoutzuur | HCl | Natronloog | NaOH (aq) |
| Salpeterzuur | HNO3 | Kalkwater | Ca(OH)2 (aq) |
| Zwavelzuur | H2SO4 | Soda | Na2CO3 |
| Koolzuurhoudend water | H2CO3 (aq) | Ammonia | NH3 (aq) |
| Azijnzuur | HAc | ||
| Fosforzuur | H3PO4 |
Laten we beginnen met de zuren uit de tabel. Zoutzuur, oftewel waterstofchloride, is een zuivere vorm een gas, maar het kan ook worden opgelost in water. Deze oplossing wordt o.a. in de maag gebruikt bij het verteren van voedsel. Salpeterzuur en zwavelzuur zijn de oorzaak van zure regen. Zwavelzuur komen we ook tegen in accu's van auto's. De formule voor azijnzuur is eigenlijk CH3COOH, maar dit wordt vaak afgekort tot HAc. Een oplossing van azijnzuur wordt ook wel azijn genoemd. Dit zuur gebruiken we o.a. bij het bereiden van voedsel en als schoonmaakmiddel. Fosforzuur komen we o.a. tegen in cola. In geconcentreerd vorm zijn deze zuren aggressief. Ze zijn bijtend en irriterend voor de huid en de slijmvliezen en kunnen in sommige gevallen zelfs brandwonden tot gevolg hebben. In de scheikundeles werk je meestal met sterk verdunde versies van deze zuren, maar ook hier is voorzichtig gebruik noodzakelijk.
En nu de basen. Ook deze stoffen zijn vaak bij hoge concentraties bijtend en irriterend. Natronloog is een oplossing van natriumhydroxide in water. Dit wordt o.a. gebruikt als gootsteenontstopper. Ammoniak is een gas dat opgelost in water bekend staat als ammonia. Deze oplossing wordt bijvoorbeeld gebruikt bij het verwijderen van vetten en bij het produceren van kunstmest. Soda werkt ook goed bij het verwijderen van vetten. Kalkwater wordt o.a. gebruikt bij het aantonen van koolstofdioxide.
Leerdoelen:
| ||||||
|
§2 Schoonmaken
In het dagelijks leven komen we scheikunde vaak tegen bij het schoonmaken. Vaak zijn schoonmaakmiddelen zuren en basen. In deze paragraaf gaan we hierover leren.
Zoals je weet zijn sommige vlekken gewoon met water uit je kleding te wassen en andere niet. De vlekken die we wel met water wegkrijgen hebben de eigenschap dat ze oplossen in water. We noemen dit ook wel hydrofiele stoffen. Een goed voorbeeld hiervan zijn de suikers in zoete drankjes, zoals limonade.
Bij hydrofobe stoffen is schoonmaken met alleen water niet voldoende. Neem bijvoorbeeld vetvlekken. Vet lost niet op in water. We kunnen deze vlekken wel verwijderen met zeep, oftewel natriumstearaat (C17H35COONa). Als we zeep oplossen, dan ontkoppelt het natriumion los en houden we het ion C17H35COO- over. Op moleculair niveau heeft zeep de vorm van kleine speldjes (een zeepmolecuul is rechts van de onderstaande afbeelding te zien). De koppen van deze speldjes zijn geladen en trekken daarom watermoleculen aan. Als gevolg zijn ze hydrofiel. De stelen van deze speldjes zijn hydrofoob. Dit betekent dat ze afgestoten worden door water. Als de zeepmoleculen in de buurt van vet komen, dan zijn de stelen hierdoor geneigd om in het vet te steken om bij het water weg te blijven (zie de onderstaande afbeelding). Op een gegeven moment is het vet helemaal ingekapseld door de zeepmoleculen en omdat de koppen van de zeepmoleculen hydrofiel zijn, kan het vetbolletje nu oplossen in water en daarmee losweken uit de kleding. Daarna kan het water worden weggespoeld. We zeggen hier dat water dient als spoelmiddel.
 (Afbeelding: AGeremia CC BY-SA 4.0)
(Afbeelding: AGeremia CC BY-SA 4.0)
Zoals je weet gebruiken we zeep ook om de huid schoon te maken. Het gebruik van zeep heeft ook nadelen. Er zit namelijk een vettig talglaagje op de huid dit zorgt dat de huid niet uitdroogt. Dit laagje wordt door zeep verwijderd. De vaak wassen kan daarom uitdroging van de huid veroorzaken.
Naast zeep wordt ook soda wordt gebruikt om bijvoorbeeld vetten te verwijderen. Net als zeep, is ook soda een basische stof. Voor vetten die zelfs met zeep en soda niet oplossen, kan een sterkere basische stof gebruikt worden, bijvoorbeeld gootsteenontstopper of ammonia.
Een ander voorbeeld van een stof die niet oplost in water is nagellak. Om nagellak op te lossen wordt vaak aceton gebruikt. Om verf op te lossen gebruiken we vaak terpentine of wasbenzine.
Een ander type vuil waar we in huis graag van af willen is kalkaanslag, ook wel ketelsteen genoemd. Zoals je weet is "water" uit de kraan geen zuiver water. Er zijn namelijk allerlei mineralen in drinkwater opgelost, met name in de vorm van calcium- en magnesiumionen. We noemen water met deze mineralen ook wel hard water. Als hard water verdampt, dan blijft kalkaanslag achter. Dit kan je bijvoorbeeld zien als je een pan water laat droogkoken. Er blijft dan een duidelijk zichtbare laag kalkaanslag achter. We zien dit ook vaak in de badkamer op plekken waar veel water verdampt, zoals bij een kraan (zie de onderstaande linker afbeelding). Een andere plek waar we kalk tegenkomen is bijvoorbeeld op het warmte-element in een waterkoker of wasmachine (zie de rechter onderstaande afbeelding). Omdat kalk warmte slecht geleid maakt dit de wasmachine op den duur minder efficiënt.

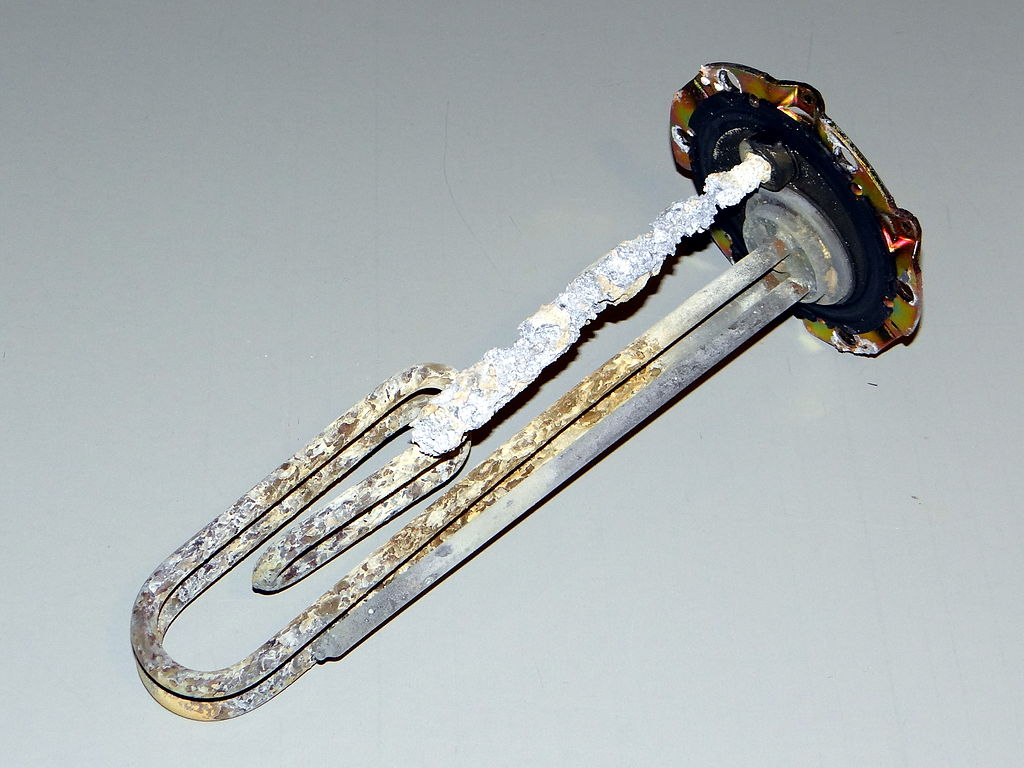 (Zbigniew Czernik; CC BY 3.0 / Hustvedt; CC BY-SA 3.0)
(Zbigniew Czernik; CC BY 3.0 / Hustvedt; CC BY-SA 3.0)
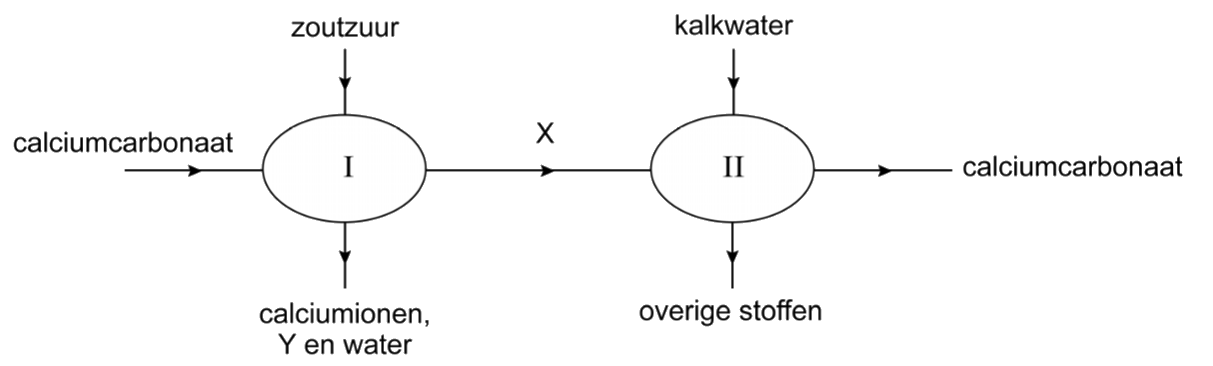
Water wordt hard als calciumcarbonaat (CaCO3) in de natuur reageert met water en koolstofdioxide. Er ontstaat hierbij een oplossing van calciumionen (Ca2+) en waterstofcarbonaationen (HCO3-). Hieronder zien we de reactie:
$$ \text{CaCO}_3\text{(s)} + \text{CO}_2 + \text{H}_2\text{O} \rightarrow \text{Ca}^{2+}\text{(aq)} + \text{2HCO}_3^- \text{(aq)} $$De omgekeerde reactie vindt plaats bij de vorming van ketelsteen (calciumcarbonaat):
$$ \text{Ca}^{2+}\text{(aq)} + \text{2HCO}_3^- \text{(aq)} \rightarrow \text{CaCO}_3\text{(s)} + \text{CO}_2 + \text{H}_2\text{O} $$De hardheid van water wordt gemeten in Duitse hardheidsgraden. Dit korten we af tot oD, of ook wel DH. Er geldt dat voor elke DH er 7,1 mg calcium- en magneisumionen in een liter water zit.
 Voorbeeld
Voorbeeld
|
|
Vraag: De hardheidsgraad van water verschilt in verschillende delen van Nederland. Rond Amsterdam is de hardheidsgraad rond de 7,8 oD. Een huishouden gebruikt per jaar gemiddeld 150 000 L water. Bereken hoeveel kilogram opgeloste mineralen gemiddeld per jaar door de leidingen onze huizen binnen stromen. Antwoord: Per Duitse hardheidsgraad zit er 7,1 mg calcium en magnesium in een liter water. Met een hardheid van 7,8 oD zit er dus in elke liter water 7,1 × 7,8 = 55,38 mg/L. Per jaar wordt er gemiddeld 150.000 liter per huishouden gebruikt. De totale hoeveelheid mineralen die elk huis binnenstroomt is dus 55,38 × 150.000 = 8 307 000 mg. Dit komt overeen met 8,3 kilogram.
|
Om kalkaanslag te voorkomen heeft het drinkwaterbedrijf al een groot deel van de verwijderd, maar niet alles. Om te voorkomen dat een afwasmachine geen laag kalk op je glazen achterlaat, wordt aan veel afwasmiddelen waterontharders toegevoegd. Dit is een stof die met Ca2+ een slecht oplosbaar zout vormt. Een voorbeeld van een ontharder is soda (Na2CO3). Hierbij ontstaat een neerslag van calcium- en carbonaationen die daarna weg te spoelen is:
$$ \text{Ca}^+ + \text{CO}_3^{2-} \rightarrow \text{CaCO}_3 \text{ (s)} $$Een andere oplossing om water te ontharden is met een ionenwisselaar. Dit is een stof met aan de buitenkant ionen, bijvoorbeeld natriumionen. Calciumionen in het water kunnen de plek innemen van deze natriumionen. Vandaar dat we spreken van een ionenwisselaar.
Als de kalkaanslag al is gevormd, kunnen we het verwijderen met zuren. Een goed voorbeeld is schoonmaakazijn.
In moderne wasmiddelen zitten een heel aantal stoffen. De belangrijkste is detergent. Dit is een stof die in werking lijkt op zeep, maar het is wel pH-neutraal, wat beter is voor de huid. Een ander voordeel is dat hiermee geen kalkzeep wordt gevormd. Dit vormt wel wanneer traditionele zeep reageert met calciumionen. Detergent heeft wel het nadeel dat het slechter is voor het milieu.
Naast detergent bevat wasmiddel vaak nog een aantal andere stoffen waarmee verschillende typen vlekken verwijderd kunnen worden. Enzymen worden bijvoorbeeld gebruikt om eiwitvlekken, (zoals zweet en bloed) schoon te maken. Een ontharder voorkomt kalkaanslag. Aan wasmiddel voor witte was is ook bleek toegevoegd om kleurstofvlekken te verwijderen. Let er wel op dat je geen gekleurde was met dit wasmiddel in aanraking laat komen, want dan ben je de kleur kwijt.
Als laatste bespreken we schuurmiddel. Hierin zitten fijne korreltjes vaste stof die een schurende werking hebben. Een voorbeeld is garagezeep, dat gebruikt wordt in garages en werkplaatsen om hardnekkige olie- en vetvlekken te verwijderen. Een ander voorbeeld is tandpasta, waarin krijt wordt gebruikt als een licht schuurmiddel om je tanden schoon te krijgen.
Leerdoelen:
| ||||||||||||||||||
| ||||||||||||||||||
Leerdoelen:
| ||||||||||||||||||
|
§3 Zuur en basen II
In deze paragraaf gaan we begrijpen wat een zuur een zuur maakt en een base een base. Dit heeft alles te maken met waterstofionen.
Zuren
Zoals je misschien is opgevallen in de tabel in de eerste paragraaf, bevat elk zuur een waterstofatoom. Dit waterstofatoom noteren we altijd als eerst in de formule. Bij het oplossen van deze stoffen komt het waterstofatoom vrij als een los waterstofion (H+). Er geldt:
| zuur | notatie zuuroplossing |
| Zoutzuur (HCl) | H+ (aq) + Cl- (aq) |
| Verdund salpeterzuur (HNO3) | H+ (aq) + NO3- (aq) |
| Verdund zwavelzuur (H2SO4) | 2 H+ (aq) + SO42- (aq) |
| Koolzuurhoudend water (H2CO3) | 2 H+ (aq) + CO32- (aq) |
| Azijn (HAc) | H+ (aq) + Ac- (aq) |
| Fosforzuur (HPO4) | H+ (aq) + PO43- (aq) |
Er geldt dat hoe groter de concentratie waterstofionen is, hoe zuurder de stof smaakt, dus hoe lager de pH is. Naast het waterstofion vormt bij het oplossen van een zuur nog een ander ion. Dit noemen we het zuurrestion.
Met deze theorie kunnen we begrijpen waarom frisdrank een zure smaak heeft. In frisdrank zit namelijk CO2 en dit kan de volgende reactie aangaan met water:
$$ \text{CO}_2 + \text{H}_2\text{O} \rightarrow \text{2 H}^+ + \text{CO}_3^{2-} $$Ook hier zien we losse waterstofion, wat de oorzaak is van de zure smaak. Als we in de bovenstaande tabel kijken, dan herkennen we de oplossing die ontstaat als koolzuurhoudend water. We noemen frisdranken daarom ook wel koolzuurhoudende dranken.
We kunnen nu ook begrijpen dat zuren onedele metalen kunnen aantasten. De waterstofionen kunnen namelijk reageren met sommige metaalatomen, waarna het metaal als ion oplost. Er ontstaat bij deze reactie altijd waterstofgas. Neem bijvoorbeeld de reactie tussen een zuur en zink:
$$ \text{Zn(s)} + \text{2 H}^+\text{(aq)} \rightarrow \text{Zn}^{2+}\text{(aq)} + \text{H}_2 \text{(g)} $$We noemen dit oplossen van metalen ook wel etsen. Vroeger werd dit gebruikt om een tekening van groeven in metaal te maken. Op het metaal werd dan eerst een waslaag aangebracht. Met een naald werd dan in deze laag een tekening gemaakt. Daarna werd het metaal bewerkt met een zuur. Alleen op de plekken waar de waslaag weggekrast was, werd het metaal opgelost. Het metaal dat overbleef kon dan dienen als een stempel om meerdere afdrukken te maken.
Basen
Laten we nu basen bespreken. Basen kunnen juist gemakkelijk een waterstofion opnemen als deze in de buurt is. Dit geldt voor de volgende ionen:
| Base | Voorbeeld |
| OH- | Natronloog: Na+ (aq) + OH- (aq) Kalkwater: Ca2+ (aq) + OH-(aq) |
| O2- | - |
| CO32- | Soda-oplossing: 2 Na2+ (aq) + CO32- (aq) Koolzuurhoudend water: H+ (aq) + CO32- (aq) |
| NH3 | Ammonia: NH3 (aq) |
OH- komt zoals je in de tabel kan lezen bijvoorbeeld voor in natronloog en kalkwater. CO32- komt bijvoorbeeld voor in soda en koolzuurhoudend water. Ammoniak wordt in opgeloste vorm ammonia genoemd.
Hoe hoger de concentratie van deze ionen, hoe sterker de base en hoe hoger de pH.
Leerdoelen:
| ||||||
|
§4 Zuur-basereacties
In deze paragraaf bestuderen we de reactie tussen zuren en basen. We noemen dit zuur-basereacties. Hiermee kunnen zuren en basen geneutraliseerd worden.
Stel we laten natronloog (NaOH (aq)) reageren met bijvoorbeeld zoutzuur (HCl (aq)). In dit geval herkennen we het hydroxide-ion (OH-) in natronloog als een base en het waterstofion (H+) in zoutzuur als het zuur. Als we deze twee ionen laten reageren, dan ontstaat water:
$$ \text{OH}^- + \text{H}^+ \rightarrow \text{H}_2\text{O} $$Merk op dat de natriumionen (Na+) en de chloride-ionen (Cl-) in de bovenstaande reactie niet genoemd zijn. Dit komt omdat deze ionen gewoon opgelost blijven in het water en geen reactie ondergaan.
Merk op dat bij deze reactie zowel het zuur als de base verdwenen is. Met een zuur kan je dus een base neutraliseren en andersom. Als we een base toevoegen aan een zuur, dan wordt de stof minder zuur. De pH van het zuur gaat dan omhoog. En als we een zuur toevoegen aan een base, dan wordt de stof minder basisch. De pH van de base gaat dan omlaag.
Dit principe wordt bijvoorbeeld gebruikt als mensen te veel maagzuur produceren. Met een basisch medicijn genaamd een Rennie, bestaande uit o.a. carbonaationen, kan een deel van dit zuur geneutraliseerd worden. Een ander voorbeeld is het neutraliseren van verzuurde grond met kalkwater (Ca(OH)2 (aq)). Tandenpoetsen werkt ook neutraliserend. Bacteriën in de mond produceren namelijk zuren die door de tandpasta geneutraliseerd worden.
Een ander voorbeeld van een zuurbasereactie is een reactie tussen het zure waterstofatoom (H+) en het basische carbonaation (CO32-). Een base met dit ion is bijvoorbeeld opgeloste soda (Na2CO3 (aq)). Als soda reageert met een zuur, dan krijgen we de volgende reactie waarbij water en koolstofdioxide vormt:
$$ \text{CO}_3^{2-} + \text{2H}^+ \rightarrow \text{CO}_2 + \text{H}_2\text{O} $$Deze reactie vindt ook plaats bij het ontkalken van bijvoorbeeld de kraan in de badkamer met behulp van een zuur. Kalk is voornamelijk calciumcarbonaat (CaCo3), dat ook het basische carbonaat-ion (CO32-) bevat. Deze reactie ziet er als volgt uit:
$$ \text{CaCO}_3\text{(s)} + \text{2H}^+ \rightarrow \text{Ca}^{2+}\text{(aq)} + \text{H}_2\text{O} + \text{CO}_2 $$De calciumionen die hierbij ontstaan zijn in het water opgelost en dat je dus gemakkelijk wegspoelen.
Voor redenen die te ver gaan om in dit hoofdstuk te bespreken gedraagt ammonia (NH3 (aq)) zich ook als een base. Als het reageert met een zuur, dan vormt NH4+:
$$ \text{NH}_3 + \text{H}^+ \rightarrow \text{NH}_4^+ $$
Leerdoelen:
| ||||
|
§5 Titreren
Met behulp van een techniek genaamd titratie kunnen we achterhalen hoeveel van een bepaald zuur of een bepaalde base in een vloeistof is opgelost. In deze paragraaf gaan we leren hoe dit werkt.
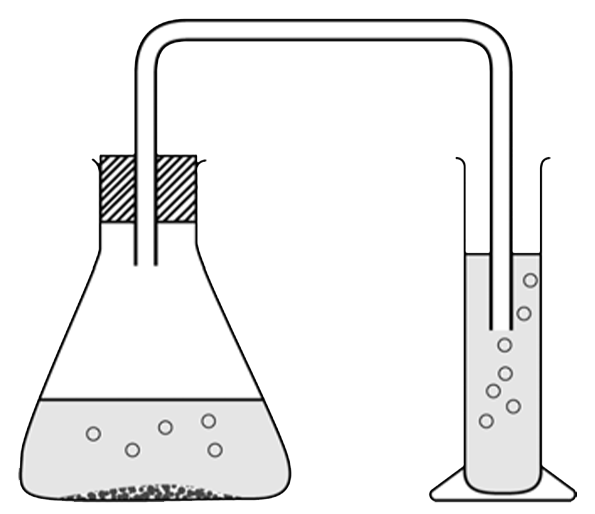
Hieronder zien we een veelgebruikte opstelling om een titratie uit te voeren. Titratie is een methode om te achterhalen hoeveel van een bepaald zuur of een bepaalde base in een oplossing aanwezig is. Het werkt als volgt. We voegen een indicator toe aan het zuur of de base. Als we een zure vloeistof hebben, dan voegen we met behulp van een buret nauwkeurig een hoeveelheid basische stof toe. Als we een basische stof hebben, dan voegen we juist een zuur toe. Dit doen we totdat de indicator omslaat (zie de rechter afbeelding).
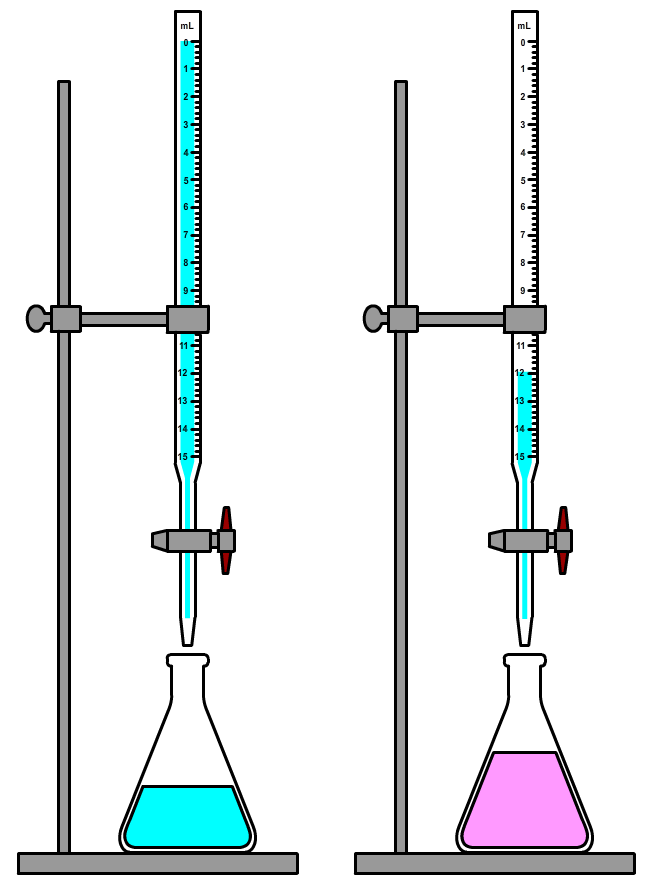
Stel we willen weten hoeveel azijnzuur er in 50 mL keukenazijn zit. We voegen hier dan bijvoorbeeld een paar druppels fenolftaleïne aan toe. Deze indicator is in het zure azijn kleurloos. Dan voegen we met de buret een base toe, bijvoorbeeld natronloog, totdat de fenolftaleïne net paars begint te kleuren (zie de onderstaande afbeelding). Voeg telkens een beetje van de base toe en schud dan goed, zodat de base zich goed kan verspreiden. Pas als een lichtroze kleur ook na het schudden blijft is het omslagpunt bereikt. Het omslagpunt van fenolftaleïne vindt plaats rond de pH 7 (eigenlijk pas bij 8, maar dit maakt niet veel verschil). Op dit moment is de stof neutraal geworden.

Bij dit experiment bleek 42 mL natronloog nodig om het omslagpunt te bereiken. Gegeven is dat 1 mL natronloog reageert met 44 mg azijnzuur (dit staat altijd vermeld in de vraag). We kunnen hiermee uitrekenen hoeveel mg azijnzuur overeenkomt met de 42 mL natronloog:
| Volume natronloog | 1 mL | 42 mL |
| Massa azijnzuur | 44 mg | 1848 mg |
Er zit dus 1848 mg = 1,8 gram azijnzuur in 50 mL keukenazijn.
Leerdoelen:
| ||
|
Stoffen die je uit je hoofd moet kennen:
|
Atomen |
|||
|
Metalen |
Niet-metalen |
||
|
Natrium |
Na |
Waterstof |
H |
|
Kalium |
K |
Koolstof |
C |
|
Magnesium |
Mg |
Stikstof |
N |
|
Calcium |
Ca |
Fosfor |
P |
|
Barium |
Ba |
Zuurstof |
O |
|
Chroom |
Cr |
Zwavel |
S |
|
IJzer |
Fe |
Fluor |
F |
|
Nikkel |
Ni |
Chloor |
Cl |
|
Platinum |
Pt |
Broom |
Br |
|
Koper |
Cu |
Jood |
I |
|
Zilver |
Ag |
Helium |
He |
|
Goud |
Au |
Neon |
Ne |
|
Zink |
Zn |
Argon |
Ar |
|
Cadmium |
Cd |
|
|
|
Kwik |
Hg |
||
|
Aluminium |
Al |
||
|
Tin |
Sn |
Metalloïde |
|
|
Lood |
Pb |
Silicium |
Si |
|
Moleculen |
|
|
Water |
H2O |
|
Waterstofperoxide |
H2O2 |
|
Koolstofdioxide |
CO2 |
|
Koolstofmonoxide |
CO |
|
Methaan |
CH4 |
|
Ammoniak |
NH3 |
|
Ethanol (alcohol) |
C6H12O |
|
Glucose |
C6H12O6 |
|
Edelgassen |
X |
|
Halogenen |
X2 |
|
Stikstof |
N2 |
|
Waterstof |
H2 |
|
Zuurstof |
O2 |
|
Ozon |
O3 |
|
Samengestelde ionen |
|
|
carbonaat-ion |
CO32- |
|
nitraat-ion |
NO3- |
|
sulfaat-ion |
SO42- |
|
fosfaat-ion |
PO43- |
|
hydroxide-ion |
OH- |
|
Ammonium-ion |
NH4+ |
|
Zouten |
||
|
Keukenzout |
Natriumchloride |
NaCl |
|
Kalkwater |
Calciumhydroxide |
Ca(OH)2 (aq) |
|
Kalksteen |
Calciumcarbonaat |
CaCO3 |
|
Soda |
Natriumcarbonaat |
Na2CO3 |
|
Natronloog |
Natriumhydroxide |
NaOH (aq) |
|
Zuren |
Basen |
||
|
Triviale naam |
Formule |
Triviale naam |
Formule |
|
Zoutzuur |
HCl (aq) |
Natronloog |
NaOH (aq) |
|
Salpeterzuur |
HNO3 |
Kalkwater |
Ca(OH)2 (aq) |
|
Zwavelzuur |
H2SO4 |
Soda |
Na2CO3 |
|
Koolzuurhoudend water |
H2CO3 (aq) |
Ammonia |
NH3 (aq) |
|
Azijnzuur |
HAc |
|
|
|
Fosforzuur |
H3PO4 |
|
|
|
Zuur-ionen |
Base-ionen |
|
H+ |
OH- |
|
|
O2- |
|
|
CO32- |
|
|
NH3 |
| BINAS: | |
| 33 | Elementen en symbolen |
| 34 | Periodiek systeem |
| 36 | Zuur-base-indicatoren |
| 42 | Triviale en rationele namen stoffen |