Hoofdstuk 2
Mengsels
§1 Zuivere stoffen en mengsels §2 Mengsels §3 Concentratie §4 Significante cijfers §5 Volume- en massaprocent
§1 Zuivere stoffen en mengsels
In dit hoofdstuk gaan we mengsels bestuderen. Het is hiervoor nodig eerst het verschil tussen zuivere stoffen en mengsels te bespreken.
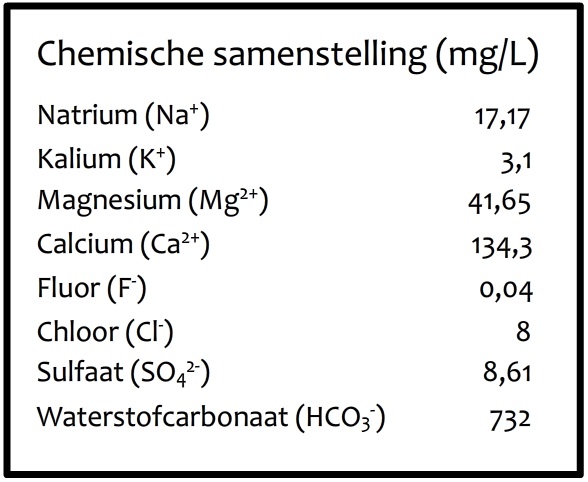
Als een bepaald materiaal uit één soort stof bestaat, dan noemen we dit materiaal zuiver. Helemaal zuiver zijn stoffen eigenlijk nooit, maar er zijn een aantal stoffen die redelijk in de buurt komen. Denk bijvoorbeeld aan een suikerklontje of een stuk koperdraad. Als een materiaal uit meerdere stoffen bestaat, dan noemen we dit een mengsel. Een voorbeeld van een mengsel is beton. Dit is een mengsel van water, zand, cement en grind. Zelfs het water uit de kraan is een mengsel. Hieronder zien we een label van een flesje mineraalwater. Op dit label staat dat er in het water allerlei stoffen zijn opgelost, zoals calcium, magnesium en natrium. Dat deze stoffen in water zijn opgelost is trouwens geen enkel probleem. Sterker nog, deze mineralen zijn belangrijk voor verschillende lichaamsfuncties.
Het is trouwens wel mogelijk om deze stoffen uit water te verwijderen (in een later hoofdstuk bespreken we hoe we dit kunnen doen). In dat geval verkrijgen we wel zuiver water. We noemen dit ook wel gedestilleerd water. Gedestilleerd water wordt geregeld in scheikunde-experimenten gebruikt.
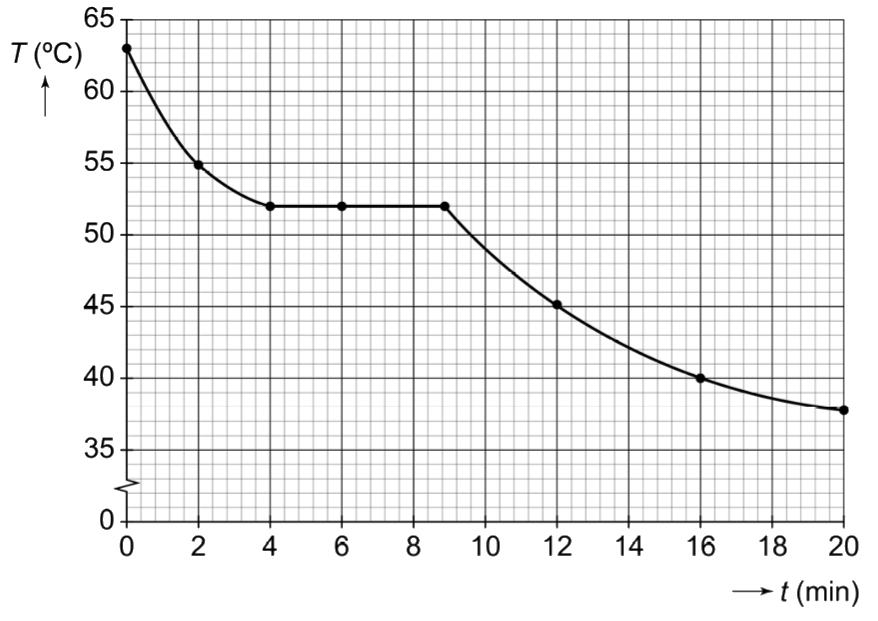
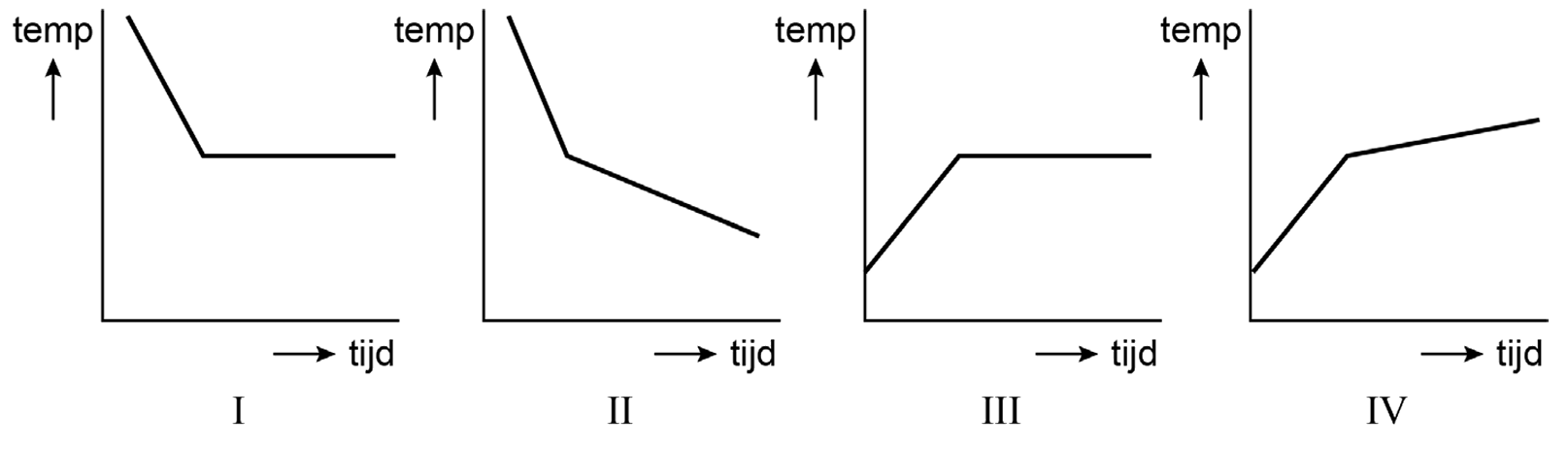
We kunnen met een simpel experiment bepalen of een materiaal een zuivere stof of een mengsel is. Neem bijvoorbeeld de zuivere stof tin. Als we deze stof geleidelijk verwarmen, dan begint het te smelten bij een temperatuur van 232 °C. Gedurende de periode waarin het tin aan het smelten is, blijft de temperatuur 232 °C. We noemen dit het smeltpunt van tin (zie de onderstaande afbeelding). Alle warmte die nu wordt toegevoegd, wordt niet gebruikt om het tin op te warmen, maar om het tin te laten smelten.
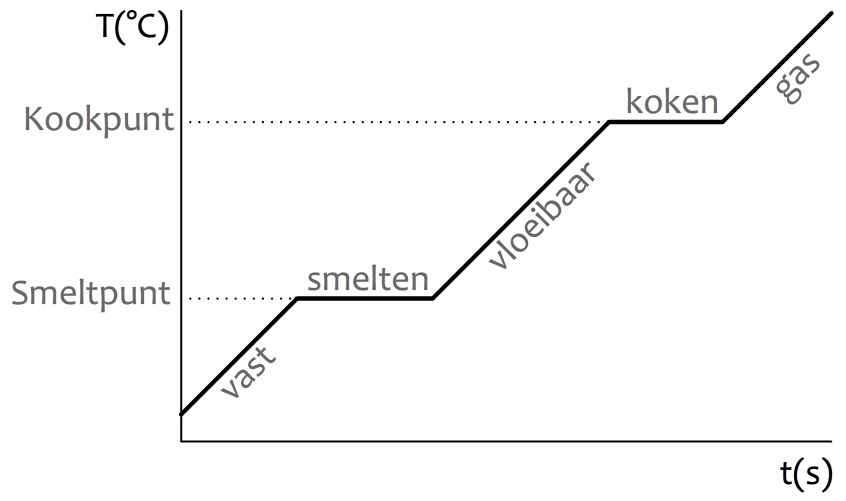
Als je de temperatuur van tin verhoogd tot 2602 °C, dan begint het te koken. Ook hier zien we dat de temperatuur constant blijft tot het moment dat al het tin is verdampt.
Als we een mengsel verwarmen, dan zien we een ander patroon. Omdat de verschillende stoffen in een mengsel allemaal andere smeltpunten hebben, is er geen eenduidig smeltpunt. Als gevolg blijft de temperatuur tijdens het smelten en het koken niet constant. De temperatuurstijging tijdens het smelten noemen we het smelttraject en de temperatuurstijging tijdens het koken het kooktraject (zie de onderstaande afbeelding).
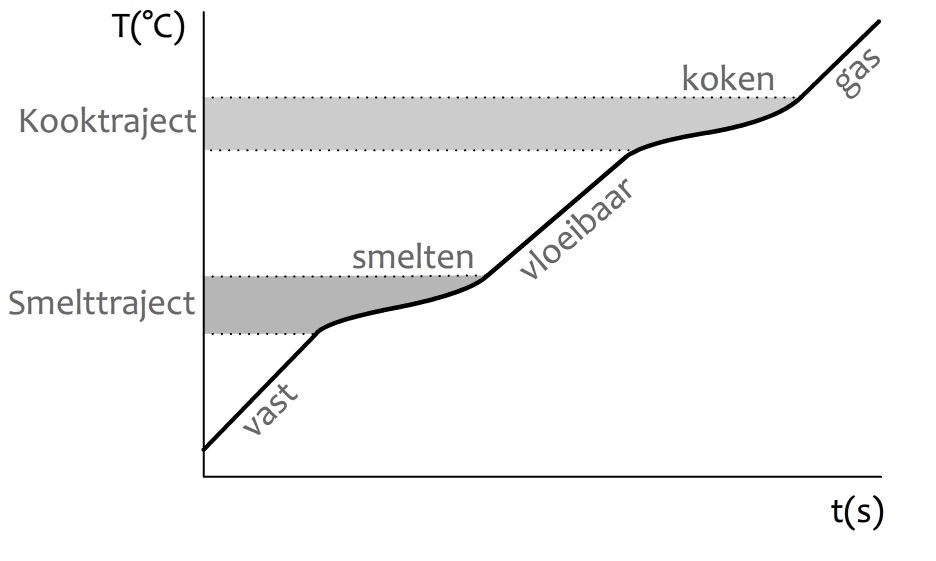
Door te achterhalen of een stof een smeltpunt of een smelttraject heeft, kunnen we dus bepalen of een stof een zuivere stof of een mengsel is!
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
| ||||||||||||||||||||
|
§2 Mengsels
In deze paragraaf gaan we het hebben over twee soorten mengsels: oplossingen en suspensies.
Een stof waar we doorheen kunnen kijken noemen we helder. Als we een stof met een vloeistof mengen en het mengsel blijft helder, dan spreken we van een oplossing. Een voorbeeld van een oplossing is zeewater. In zeewater zit zout opgelost, maar toch kunnen we het zout niet zien. Een ander voorbeeld is het oplossen van suiker in thee. Ook hier lijkt het suiker te "verdwijnen" in het water. Oplossingen kunnen wel een kleur hebben. Thee heeft bijvoorbeeld vaak een oranje of bruine kleur.
Hoe komt het dat oplossingen helder zijn? Neem bijvoorbeeld zeewater. Zeewater is helder omdat de zoutdeeltjes zich volledig verspreiden in het water (zie de onderstaande afbeelding). We noemen een dergelijk mengsel een homogeen mengsel. Een zoutdeeltje is een miljoen keer kleiner dan een millimeter en kan dus niet met onze ogen gezien worden. Omdat alle deeltjes los van elkaar door het water bewegen, kunnen we ze dus niet zien.
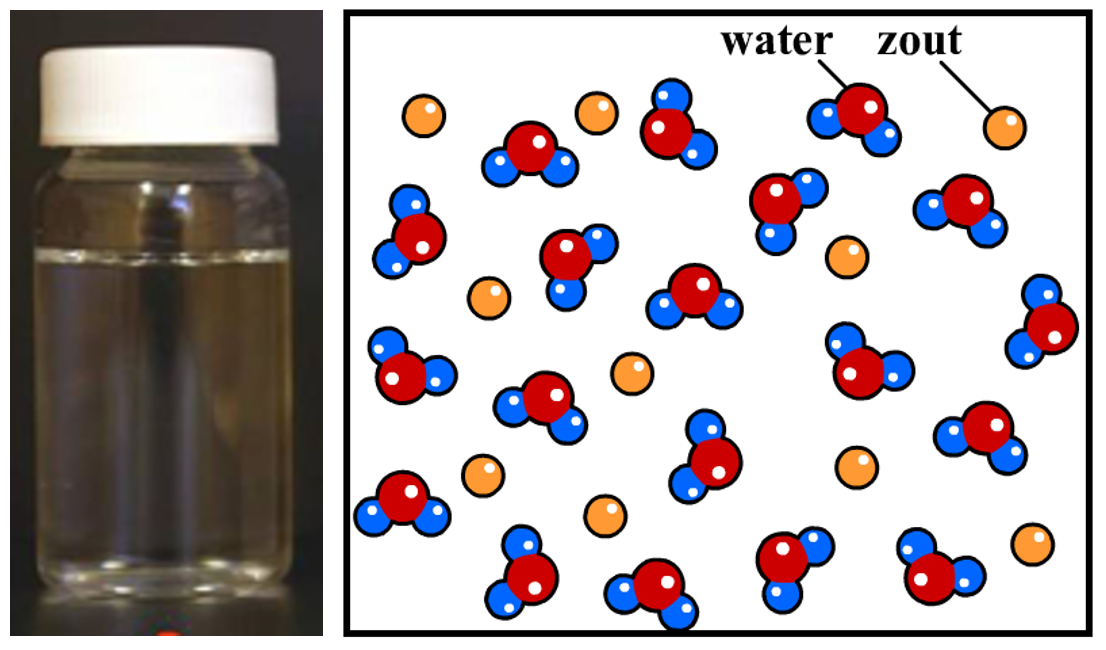
Ook gassen vormen homogene mengsels. Neem bijvoorbeeld de lucht. De lucht bestaat o.a. uit de gassen stikstof, zuurstof en een beetje koolstofdioxide. Omdat de deeltjes in een gas los van elkaar bewegen, kunnen gassen altijd goed mengen en vormen ze dus altijd homogene mengsels. Elk mengsel van gassen is daarom altijd helder (maar net als bij vloeistoffen kunnen deze gassen wel een kleur hebben).
Een vloeistof waar we niet doorheen kunnen kijken noemen we troebel. Als we een stof met een vloeistof mengen en het mengsel wordt troebel, dan spreken we van een suspensie. Er ontstaat bijvoorbeeld een suspensie als we krijtstof mengen met water. Een suspensie ontstaat doordat het krijt zich niet perfect mengt met het water. De krijtdeeltjes blijven in kleine klontjes aan elkaar plakken en deze klontjes zweven rond in het water (zie de onderstaande afbeelding). Omdat deze klontjes groot genoeg zijn om met onze ogen te kunnen zien, kunnen we niet door een suspensie heen kijken. We noemen een dergelijk mengsel een heterogeen mengsel.
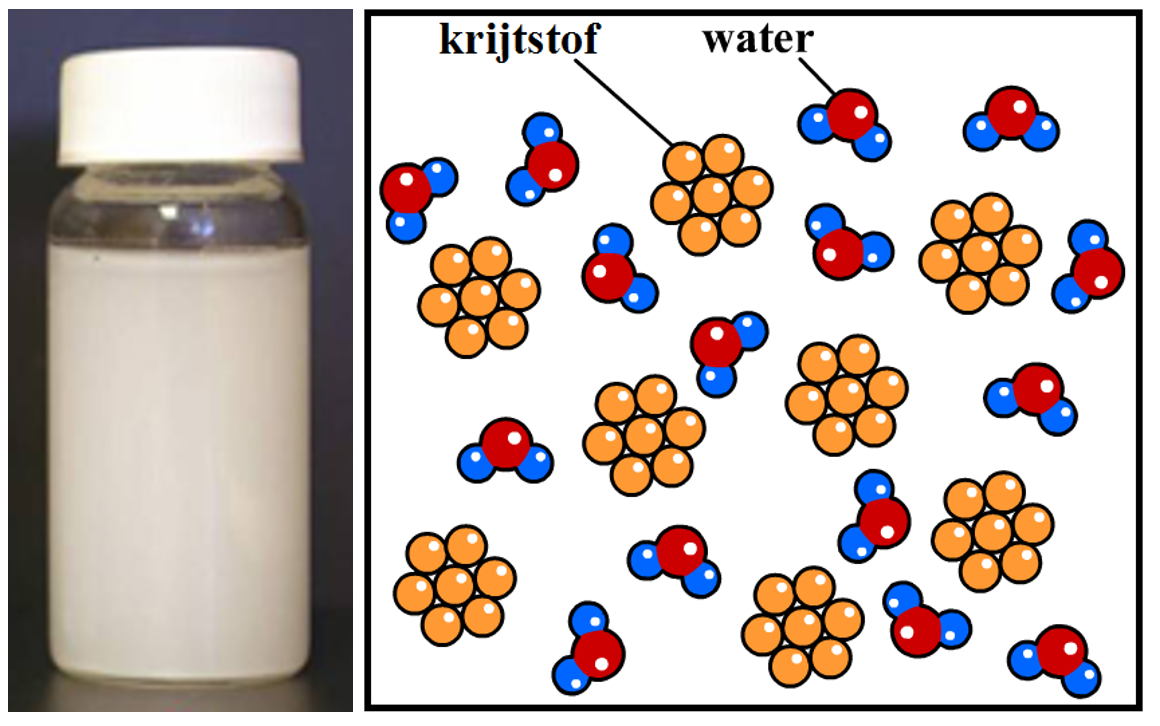
Naast suspensies bestaan er ook nog andere heterogene mengsels. Een voorbeeld is rook. Rook is een collectie van kleine stukjes vaste stof die in de lucht zweven. Rook is dus geen gas, maar bestaat uit kleine stukjes vaste stof (zie de twee onderstaande afbeeldingen).

 (Afbeelding: US Coast Guard; PD / Reinald Kirchner CC BY-SA 2.0)
(Afbeelding: US Coast Guard; PD / Reinald Kirchner CC BY-SA 2.0)
Een ander voorbeeld is een nevel. Nevel is een collectie van kleine vloeibare druppeltjes die in de lucht zweven. We kunnen bijvoorbeeld een nevel maken door een fles haarlak of deodorant te spuiten. Ook wolken en mist zijn nevels.


 (Afbeelding: Pixabay; PD / Keith Miller; PD / Pixabay; PD)
(Afbeelding: Pixabay; PD / Keith Miller; PD / Pixabay; PD)
Een ander voorbeeld van een heterogeen mengsel is schuim. Een schuim bestaat uit gasbelletjes die zich in een vloeistof of een vaste stof bevinden. Denk bijvoorbeeld aan de "prik" in cola. Dit bestaat uit kleine belletjes koolstofdioxide. Een ander voorbeeld is piepschuim. Dit bestaat uit plastic bolletjes gevuld met lucht.

 (Afbeelding: Pixabay; PD)
(Afbeelding: Pixabay; PD)
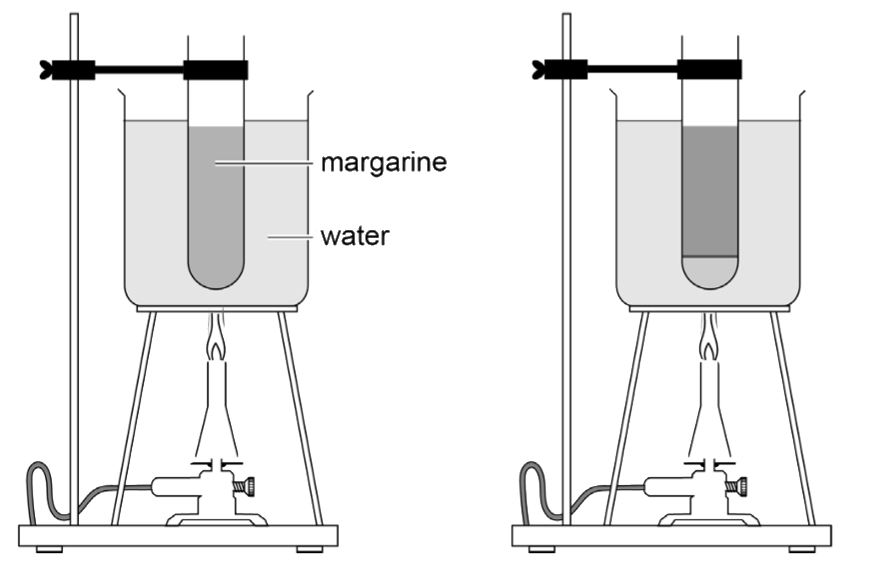
Het laatste voorbeeld van een heterogeen mengsel is een emulsie. Een emulsie bestaat uit stoffen die onder normale omstandigheden niet mengen, maar die door een extra stof, genaamd de emulgator, toch mengen. Een aantal emulgatoren kan je in BINAS vinden tussen de E-nummers.
Voorbeelden van emulsies zijn mayonaise en crèmes. Mayonaise bestaat voornamelijk uit olie en een beetje azijn. Zoals je in de linker onderstaande afbeelding kan zien, mengen deze vloeistoffen onder normale omstandigheden niet. Als emulgator voegen we eigeel toe en zo ontstaat de emulsie mayonaise.
 (Afbeelding: Victor Blacus; CC BY-SA 4.0 / Takeaway; CC BY-SA 3.0)
(Afbeelding: Victor Blacus; CC BY-SA 4.0 / Takeaway; CC BY-SA 3.0)
Een crème is een emulsie bestaande uit o.a. water, een vet of een olie en een emulgator. Crèmes worden op de huid gesmeerd om de huid te verzorgen of als medicatie tegen bijvoorbeeld huidaandoeningen.
 (Afbeelding: Victor Blacus; CC BY-SA 4.0 / Takeaway; CC BY-SA 3.0)
(Afbeelding: Victor Blacus; CC BY-SA 4.0 / Takeaway; CC BY-SA 3.0)
Crèmes behoren trouwens tot de cosmetische middelen. Dit zijn producten waarmee je je lichaam schoonmaakt, verzorgt of verfraaid. Hiertoe behoren dus crèmes, maar bijvoorbeeld ook zeep, haargel, deodorant en make-up.
Hieronder zijn de homogene en heterogene mengsels uit de tekst nog eens samengevat:
| Homogeen mengsel | Heterogeen mengsel |
| Oplossing | Suspensie |
| Gasmengsel | Rook |
| Nevel | |
| Schuim | |
| Emulsie |
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
| ||||||||||||||||
|
§3 Concentratie
In deze paragraaf gaan we leren rekenen met het begrip concentratie. Een bekend voorbeeld waarbij concentratie een rol speelt is limonade. Hoe meer siroop er in een bepaalde hoeveelheid water wordt gedaan, hoe hoger de concentratie.
Als we twee stoffen met elkaar mengen, dan kunnen we dit in verschillende verhoudingen doen. Denk bijvoorbeeld aan limonade. We kunnen zelf kiezen hoeveel siroop en hoeveel water we toevoegen bij het maken van limonade. De hoeveelheid water en de hoeveelheid siroop bepalen samen hoe zoet de limonade zal smaken. Als de limonade erg zoet is, dan spreken we van een hoge concentratie siroop. Als je de siroop bijna niet proeft, dan spreken we van een lage concentratie siroop.
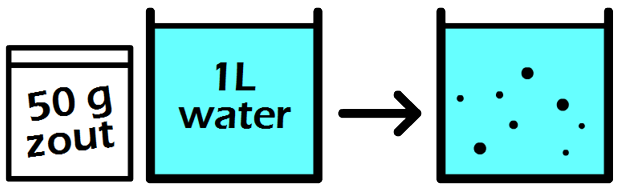
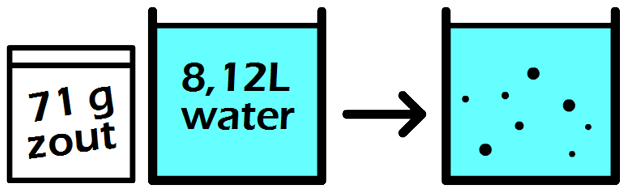
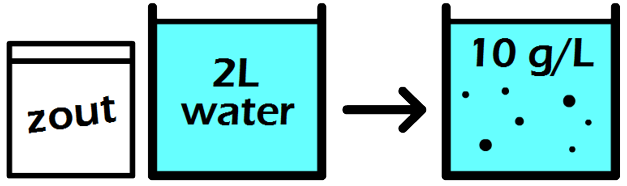
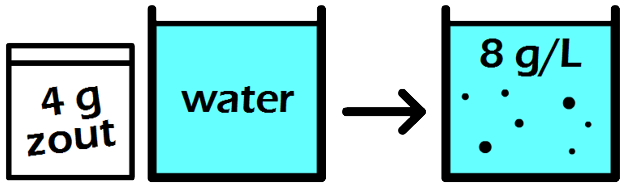
In de onderstaande afbeelding zien we een maatkolf. Stel we schenken 24 gram siroop in de maatkolf en vullen dit daarna aan met water tot aan de stippellijn. Zoals aangegeven op de maatkolf, hebben we dan 1000 mL (1 liter) limonade. De limonade die we nu gemaakt hebben, heeft een siroopconcentratie van 24 gram per liter (24 g/L).
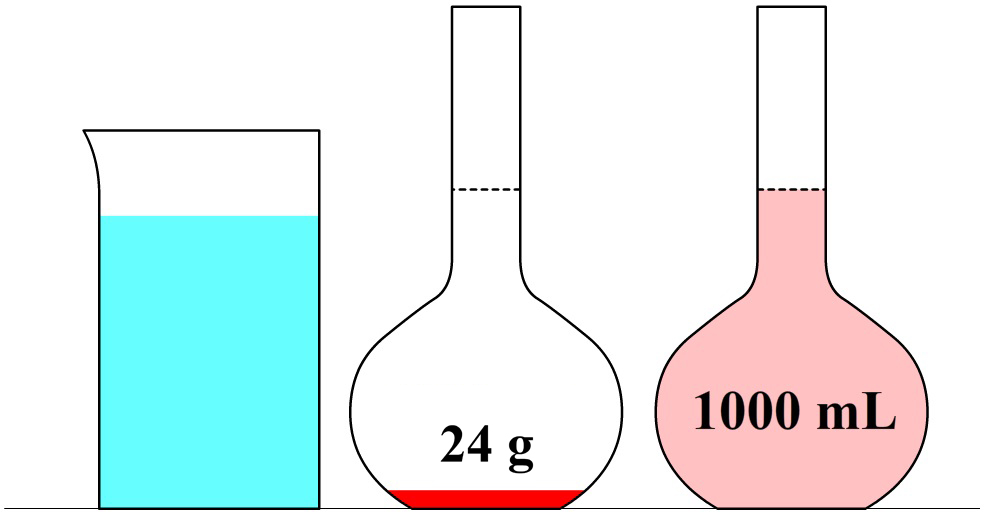
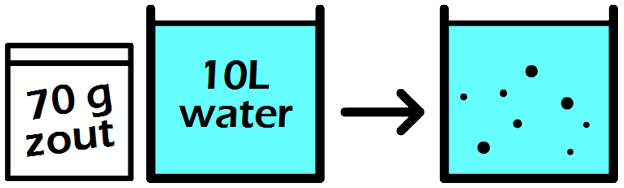
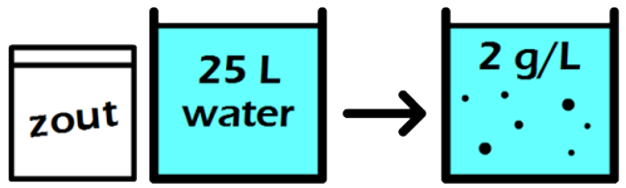
In de volgende maatkolf schenken we 24 gram siroop in een maatkolf en vullen dit aan tot we 2000 mL (2 liter) limonade hebben. Elke liter limonade bevat in dit geval dus 24 / 2 = 12 gram siroop. De siroopconcentratie is in dit geval dus 12 g/L. In dit tweede voorbeeld is de siroopconcentratie dus lager en als gevolg smaakt de limonade minder zoet.
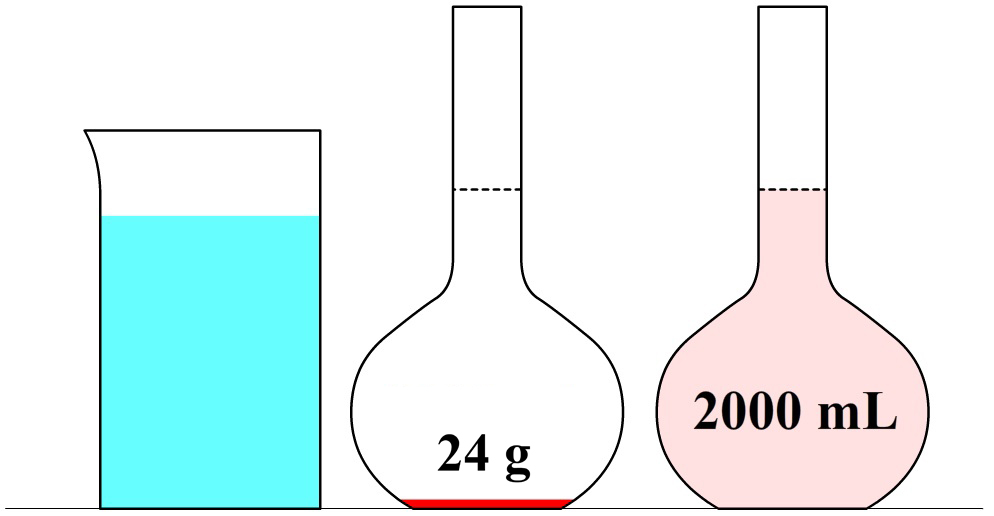
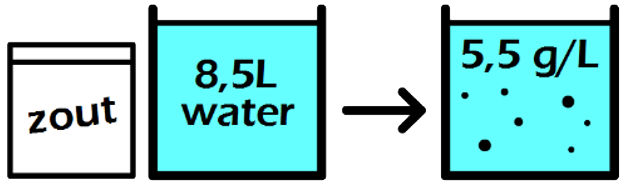
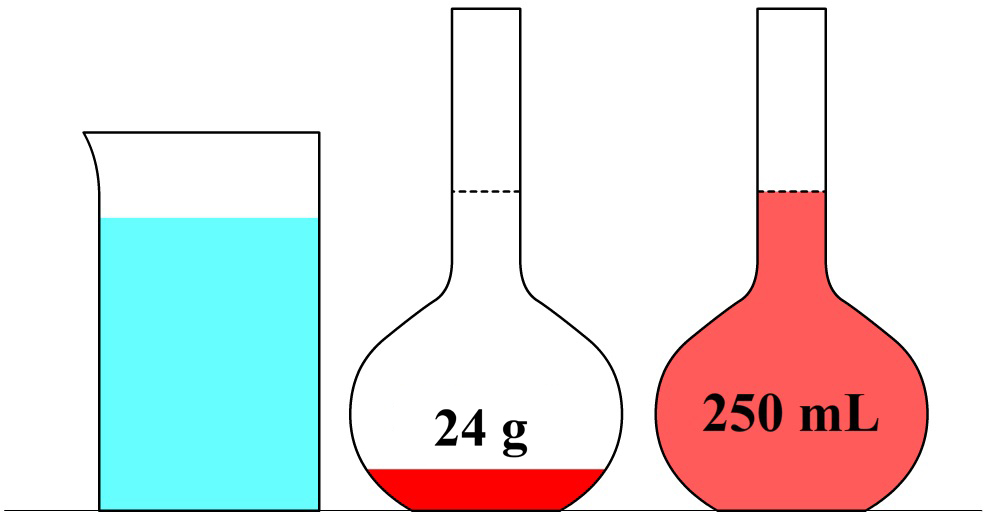
In de volgende maatkolf schenken we 24 gram siroop in een maatkolf en vullen dit aan tot we 250 mL (0,25 liter) limonade hebben. In dit geval zou een liter van deze limonade 24 × 4 = 96 gram siroop bevatten. Deze limonade heeft dus een siroopconcentratie van 96 g/L. In dit voorbeeld is de concentratie dus hoger en smaakt de limonade dus zoeter.
 Voorbeeld
Voorbeeld
| ||||||||||||||||||
|
Vraag: Een leerling maakt eerst 1,2 L limonade met daarin 10 gram siroop en daarna ook nog 0,15 L limonade met daarin 2,0 gram siroop. Welke limonade smaakt zoeter? Antwoord: We kunnen deze vraag beantwoorden door de gegevens te noteren in een verhoudingstabel. De eerste soort limonade bevat 10 gram siroop en heeft een volume van 1,2 liter. Als we de concentratie van deze limonade willen weten, dan willen we weten hoeveel gram siroop er in 1 liter van deze limonade opgelost is:
De gemakkelijkste manier om dit soort problemen op te lossen is door kruislings te vermenigvuldigen. Je vermendigvuldigt in dat geval de twee getallen die diagonaal genoteerd zijn en daarna deel je door het overgebleven getal. In de instructiefilmpjes bij deze paragraaf wordt deze techniek uitgebreid uitgelegd. We vinden hiermee: $$ \frac{10 \times 1}{1,2} = 8,3 \text{ g} $$Dit antwoord vullen we in de verhoudingstabel in:
Deze limonade heeft dus een concentratie van 8,3 g/L. Op dezelfde manier vinden we de concentratie van de tweede limonade. Hier hadden we 2,0 gram siroop in 0,15 liter limonade. De concentratie wordt hiermee:
Deze limonade heeft dus een concentratie van 13 g/L. Met deze gegevens zijn we in staat de vraag te beantwoorden. Omdat de tweede limonade een hogere concentratie heeft, smaakt deze limonade het zoetst.
|
 Voorbeeld
Voorbeeld
| ||||||
|
Vraag: Een leerling maakt 2,5 L limonade met een concentratie van 34 g/L. Hoeveel gram siroop is er gebruikt om deze limonade te maken? Antwoord: Een siroopconcentratie van 34 g/L betekent dat er 34 gram siroop gebruikt is voor één liter van deze limonade. Door kruislings te vermenigvuldigen vinden we dan voor 2,5 liter limonade:
Er is dus 85 gram siroop gebruikt voor de 2,5 L limonade.
|
 Voorbeeld
Voorbeeld
| ||||||
|
Vraag: Een leerling voegt 35,0 mL siroop met een massa van 40,0 gram bij 200,0 mL water voor het maken van limonade. Bereken de concentratie van de siroop in de limonade. Antwoord: Het volume van de limonade bestaat uit het volume van de siroop (35,0 mL) plus het volume van het water (200,0 mL). Het totale volume van de limonade is dus 200,0 + 35,0 = 235,0 mL. Dit komt overeen met 0,2350 L. Hierin zit 40,0 g siroop opgelost. We willen de concentratie weten. Dit is de hoeveelheid gram per liter. We vinden dit met een verhoudingstabel:
De concentratie is dus 170 g/L.
|
Als laatste bespreken we een examenvraag. De vragen over concentratie behoren geregeld tot de wat lastigere vragen uit het examen. Rustig lezen helpt bij dit soort vragen.
 Voorbeeld
Voorbeeld
| ||||||||||||
|
Vraag: Om op de maan te leven zouden we zuurstof uit maansteen (regoliet) kunnen halen. Een astronaut gebruikt gemiddeld 550 liter zuurstof per dag. Bereken hoeveel kilogram regoliet minimaal nodig is om 550 liter zuurstof te produceren. Neem aan dat zuurstof een dichtheid heeft van 1,43 g per liter en dat per gram regoliet 0,42 gram zuurstof kan worden gevormd. (Bron: Examen VMBO-T, 2023-1) Antwoord: Laten we de gegevens eerst even op een rij zetten: - Een astronaut heeft 550 liter zuurstof per dag nodig. - Zuurstof heeft een dichtheid van 1,43 gram per liter. - Er kan 0,42 gram zuurstof gevormd worden met één gram regoliet. We willen weten hoeveel kilogram regoliet nodig is om genoeg zuurstof te produceren voor de astronaut. Laten de eerst naar de eerste twee gegevens kijken. Elke liter zuurstof heeft een massa van 1,43 gram. We kunnen hiermee uitrekenen hoeveel de massa is van de 550 liter zuurstof die de astronaut nodig heeft:
Er is dus in totaal 786,5 gram zuurstof per dag nodig voor de astronaut. Nu gebruiken we het derde gegeven. Er kan 0,42 gram zuurstof gevormd worden met één gram regoliet. We kunnen hiermee uitrekenen hoeveel gram regoliet er nodig is voor 786,5 gram zuurstof:
Er is dus 1872 g regoliet per dag nodig om genoeg zuurstof te produceren voor een astronaut. Let er op dat in de vraag staat dat we de massa in kilogram willen weten. Omgeschreven naar kilogrammen is dit afgerond 1,9 kg.
|
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
(Bron: Examen VMBO-T, 2023-1) |
§4 Significante cijfers
In deze paragraaf bespreken we hoe we afronden in de natuur- en scheikunde. Dit doen we met behulp van significante cijfers.
In de natuurkunde en de scheikunde werken we met metingen en metingen zijn vaak onnauwkeurig. Het ligt daarom voor de hand dat we cijfers in de natuurkunde afronden op basis van de nauwkeurigheid van de meting. Hoe nauwkeuriger de meting is, op hoe meer getallen we de meetwaarde afronden.
Neem bijvoorbeeld het potlood in de volgende afbeelding. De meeste mensen zullen waarschijnlijk zeggen dat dit potlood een lengte van 11 cm heeft. We kunnen de lengte van het potlood echter nauwkeurig genoeg aflezen, dat we zeker weten dat het eerste getal achter de komma een nul moet zijn. We zeggen daarom dat de lengte van dit potlood 11,0 cm is. We zien hier dus dat bij natuurkunde en scheikunde de nullen achter de komma van belang zijn!
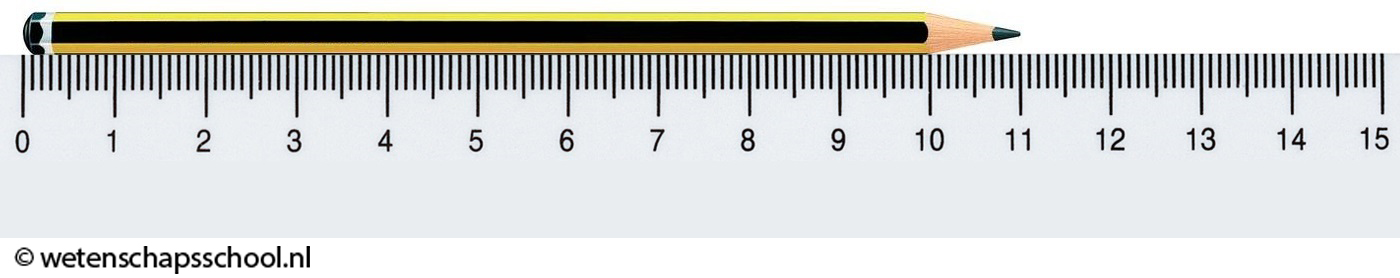
De cijfers waarin we een meetwaarde mogen noteren noemen we significante cijfers. De meetwaarde 11,0 cm bestaat dus uit drie significante cijfers.
Belangrijk is om te weten dat nullen aan de linkerkant van een meetwaarde niet meetellen als significante cijfers. De meetwaarde 0,0040 meter heeft dus slechts twee significante cijfers.
Er zijn ook getallen in de natuurkunde die wel precies zijn. Neem bijvoorbeeld het aantal leerlingen in een klaslokaal, het aantal ramen in een gebouw, het aantal zijden van een vierkant enzovoorts. We noemen deze precieze getallen telwaarden. Omdat deze waarden precies zijn, hebben ze dus een oneindige hoeveelheid significante cijfers. Als gevolg is het bij berekeningen nooit nodig om naar de significante cijfers van telwaarden te kijken.
Maar wat nu als we een rekensommetje doen met verschillende meetwaarden? Op hoeveel cijfers moeten we het antwoord van dit sommetje dan afronden? De regel is dat we bij vermenigvuldigen en delen het antwoord schrijven in evenveel significante cijfers als de meetwaarde met het minst aantal significante cijfers.
Laten we een voorbeeld bespreken. Stel een leerling heeft een limonade gemaakt met een volume van 4,510 L met daarin 358 gram siroop en we willen de concentratie uitrekenen. 4,510 heeft vier significante cijfers en 358 heeft er drie. Drie significante cijfers is het minst, dus we willen het antwoord ook op drie significante cijfers afronden. De verhoudingstabel komt er zo uit te zien:
| Massa siroop | 358 g | ... g |
| Volume limonade | 4,510 L | 1 L |
Door kruislings te vermenigvuldigen vinden we op onze rekenmachine:
$$ \text{concentratie} = 79,3791574279 \text{ g/L}$$Op drie significante cijfers afgerond wordt dit:
$$ \text{concentratie} = 79,4 \text{ g/L}$$Nog een voorbeeld. Stel we voegen 3000 mg zoutzuur toe aan 2,0 L water en we willen de concentratie weten in mg/L. 3000 heeft vier significante cijfers en 2,0 heeft er twee. Twee significante cijfers is het minst, dus we willen het antwoord ook op twee cijfers afronden. De verhoudingstabel komt er zo uit te zien:
| Massa siroop | 3000 mg | ... mg |
| Volume limonade | 2,0 L | 1 L |
Als we de concentratie op onze rekenmachine berekenen, dan vinden we:
$$ \text{concentratie} = 1500 \text{ mg/L} $$Maar hoe noteren we het getal 1500 in slechts twee cijfers? Dit doen we met behulp van machten van tien. We schrijven:
$$ \text{concentratie} = 1,5 \times 10^3 \text{ mg/L} $$Machten van tien werken als volgt. 1,5 × 103 is gelijk aan 1500. Als we een waarde vermenigvuldigen met 103, dan schuift de komma dus drie plaatsen op naar rechts. Het getal 15 × 10-2 is gelijk aan 0,15. Als we een waarde vermenigvuldigen met 10-2, dan schuift de komma dus twee plaatsen op naar links.
In de praktijk is het bij vermenigvuldigen en delen niet nodig om bij elke rekenstap het antwoord in het juiste aantal significante cijfers te schrijven. Bij het eindantwoord is dit echter wel verplicht! Als je het eindantwoord gevonden hebt, kijk dan terug in de vraag naar alle meetwaarden die je gebruikt hebt en ook naar de waarden uit BINAS die je gebruikt hebt en kijk welke waarde het minst aantal significante cijfers heeft. Schrijf je antwoord dan ook in dit aantal significante cijfers op.
Voor optellen en aftrekken bestaat een andere regel. We kijken nu naar het aantal cijfers achter de komma van de gebruikte meetwaarden. We schrijven het antwoord op in evenveel cijfers achter de komma als de meetwaarde met het minst aantal cijfers achter de komma. Stel dat we bijvoorbeeld 15,3 meter optellen bij 0,32 meter, dan vinden we op onze rekenmachine:
$$ 15,3 + 0,32 = 15,62 \text{ m} $$15,3 heeft slechts één cijfer achter de komma en 0,32 heeft er twee. Eén cijfer achter de komma is het minste, dus we schrijven het antwoord ook maar met één cijfer achter de komma:
$$ 15,3 + 0,32 = 15,6 \text{ m} $$Let er wel op dat je de waarden eerst omschrijft naar dezelfde eenheid en met dezelfde tienmacht.
Naast machten van tien is het soms ook mogelijk om voorvoegsels te gebruiken. Ook deze kan je in BINAS terugvinden. In de onderstaande tabel staan een aantal belangrijke voorvoegsels:
|
M |
mega |
106 |
|
k |
kilo |
103 |
|
m |
milli |
10-3 |
|
μ |
micro |
10-6 |
Met voorvoegsels kunnen we een meetwaarde als 3,45 × 10-6 m bijvoorbeeld ook schrijven als 3,45 μm.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§5 Volume- en massaprocent
In deze paragraaf gaan we leren concentraties weer te geven als procenten. Dit kan op twee manieren: met massaprocent en met volumeprocent.
Tot nu toe hebben we concentraties weergegeven in gram per liter. We kunnen concentraties echter ook weergeven in procenten. Er zijn twee manieren waarop we dit kunnen doen.
Kijk bijvoorbeeld eens naar de rechter afbeelding. We zien een mengsel bestaande uit rode en gele deeltjes. Hieronder bereken we welk percentage van het volume van het mengsel uit gele deeltjes bestaat. Het totale volume van het mengsel is 4 L en het volume van de gele deeltjes is 1 L. Hiermee vinden we:
|
Volume |
4 L |
1 L |
|
Volumeprocent |
100 vol% |
25 vol% |
We zeggen dan dat de concentratie 25 volumeprocent is. We korten dit meestal af tot 25 vol%.
Naast het volume kunnen we ook naar de massa kijken. Stel we willen weten welk percentage van de massa van het mengsel uit gele deeltjes bestaat. De totale massa van het mengsel is 10 kg en dit stellen we gelijk aan 100%. De massa van de gele deeltjes is 4 kg. Hiermee vinden we:
|
Massa |
10 kg |
4 kg |
|
Massaprocent |
100% |
40% |
We zeggen dan dat de concentratie 40 massaprocent is. Afgekort schrijven we dit gewoon op als 40%.
Zoals je in dit voorbeeld kan zien, kan voor hetzelfde mengsel het volumepercentage (25 vol%) en het massapercentage (40%) verschillen.
 Voorbeeld
Voorbeeld
| ||||||
|
Vraag: 1,50 liter wijn bevat 12,0 vol% alcohol. Bereken hoeveel milliliter alcohol er in de fles zit. Antwoord: Hiervoor gebruiken we weer een verhoudingstabel. Het totale volume van de wijn is 1,50 L. Dit komt dus overeen met 100 vol%:
De fles bevat dus 0,180 L alcohol. In de vraag staat dat we het volume willen weten in milliliter. 0,180 L is gelijk aan 180 mL. De gegevens in de vraag hebben elk drie significante cijfers. Het is dus juist dat het antwoord ook in drie significante cijfers geschreven is.
|
 Voorbeeld
Voorbeeld
| ||||||
|
Vraag: Aan 120 mL water is 8 mL siroop toegevoegd. Bereken de siroopconcentratie in volumeprocent. Antwoord: We hebben in totaal 120 + 8 = 128 mL limonade. Dit is het totale volume, oftewel 100 vol%. We willen weten hoeveel volumeprocent bestaat uit siroop. Als we de verhoudingstabel invullen, vinden we:
De siroopconcentratie is afgerond 6 vol%. We kijken nog even naar de significantie. In de verhoudingstabel gebruiken we 8 mL in een vermenigvuldiging. Deze waarde heeft maar één significant cijfer. Vandaar dat we het antwoord hebben afgerond op één significant cijfer.
|
 Voorbeeld
Voorbeeld
| ||||||
|
Vraag: In 250 gram halvarine zit 40% vet. Bereken hoeveel kilogram vet er in de halvarine zit. Antwoord: We lossen dit weer op met een verhoudingstabel. De totale massa is 250 gram en komt overeen met 100%:
Er zit dus 100 gram vet in de halvarine. In de vraag staat dat we het antwoord willen weten in kilogram. 100 gram is gelijk aan 0,10 kg. Het gegeven met het minst aantal significante cijfers is 40%. Dit heeft twee significante cijfers. Het antwoord is dus ook in twee significante cijfers geschreven. Nullen aan de linkerzijde tellen niet mee. Vandaar dat het antwoord geschreven is als 0,10 kg.
|
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
| BINAS: | |
| 1 | Omrekenen kelvin en graden Celsius |
| 2 | Omrekenen volumes |
| 3 | Voorvoegsels |
| 15-17 | Dichtheid, smeltpunt en kookpunt van verschillende stoffen |