Hoofdstuk 6
Chemische reacties
§1 Reactievergelijkingen §2 Verbrandingsreacties en neerslagreacties §3 Reactiesnelheid
§1 Reactievergelijkingen
In dit hoofdstuk gaan we chemische reacties bestuderen. In deze eerste paragraaf gaan we leren reactievergelijkingen uit te schrijven met onze kennis van atomen en moleculen.
In een eerder hoofdstuk hebben we geleerd chemische reacties uit te schrijven met een reactieschema. In een reactieschema schrijven we schematisch op welke stoffen voor de reactie aanwezig waren (de reactanten) en welke stoffen na de reactie zijn ontstaan (de producten):
$$ \mathrm{reactant} 1 + \mathrm{reactant} 2 + \mathrm{...} \rightarrow \mathrm{product} 1 + \mathrm{product} 2 + \mathrm{...} $$We hebben toen de verbranding van staalwol als voorbeeld genomen. Zoals we toen gelezen hebben, reageert het ijzer waaruit het staalwol bestaat met de zuurstof in de lucht en ontstaat er ijzeroxide. De reactanten zijn dus ijzer en zuurstof en het product is ijzeroxide. We schrijven dit op als:
$$ \mathrm{ijzer} + \mathrm{zuurstof} \rightarrow \mathrm{ijzeroxide} $$In deze paragraaf gaan we dit soort reactieschema's uitschrijven met chemische formules. We spreken in dat geval van reactievergelijkingen. Om dit te begrijpen, bestuderen we het werk van de wetenschapper John Dalton.
In de 19de eeuw vond John Dalton aanwijzingen voor het bestaan van atomen en moleculen. Hieronder zien we een schets die Dalton hiervan maakte.

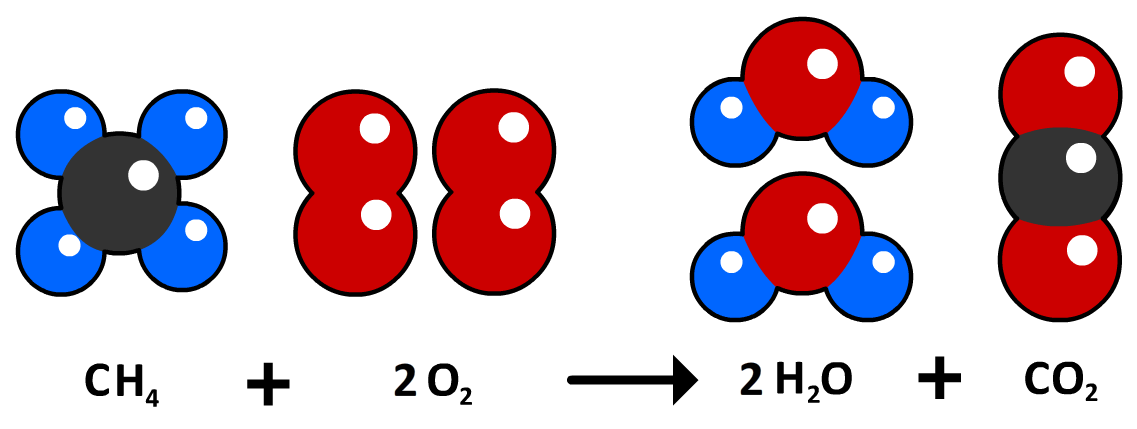
Dalton begreep dat tijdens chemische reacties de moleculen veranderen, maar de atomen niet. Hieronder zien we bijvoorbeeld een reactie tussen één methaanmolecuul (CH4) en twee zuurstofmoleculen (2 O2). Bij deze reactie ontstaat één koolstofdioxidemolecuul (CO2) en twee watermoleculen (2 H2O). Merk op dat de atomen die voor de reactie aanwezig waren, ook na de reactie aanwezig zijn. Aan beide kanten van de vergelijking zien we vier waterstofatomen, vier zuurstofatomen en één koolstofatoom. Het enige dat dus gebeurt is, is dat de atomen onderdeel zijn geworden van andere moleculen.
Om reactievergelijkingen goed te begrijpen is het handig reacties na te bouwen met bijvoorbeeld legoblokjes (zie de onderstaande afbeelding). Voor en na de reactie zien we hier vier rode blokjes, vier blauwe blokjes en één zwart blokje. Tijdens chemische reacties veranderen de bouwsels (de moleculen), maar de legoblokjes zelf (de atomen) blijven onveranderd.

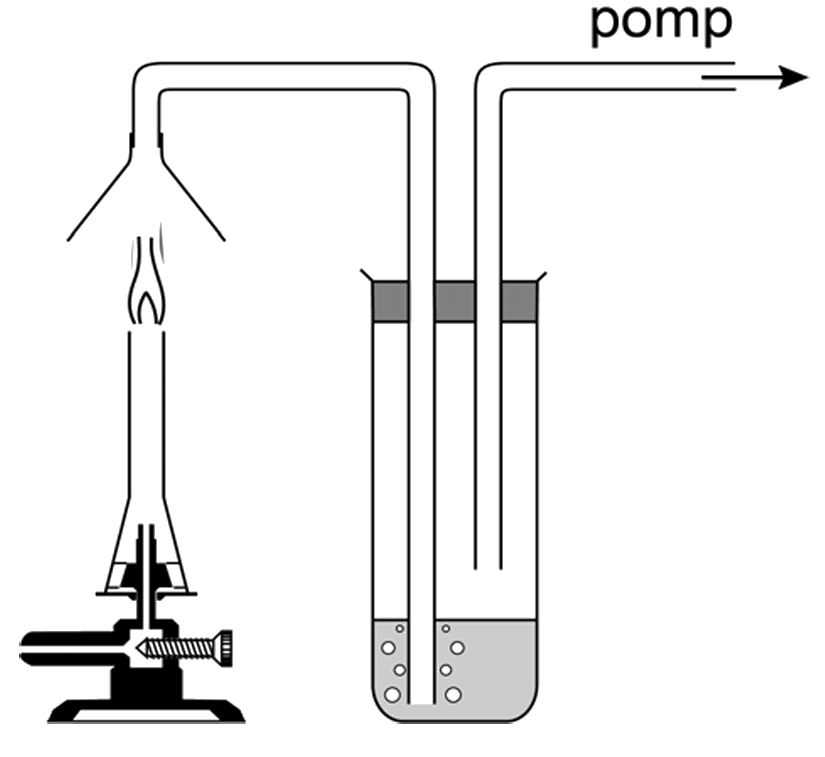
Laten we nog een voorbeeld bestuderen. Als we met elektrolyse water (H2O) ontleedt, dan ontstaat zuurstofgas (O2) en waterstofgas (H2).
Hieronder zien we een eerste poging om de reactie uit te schrijven:
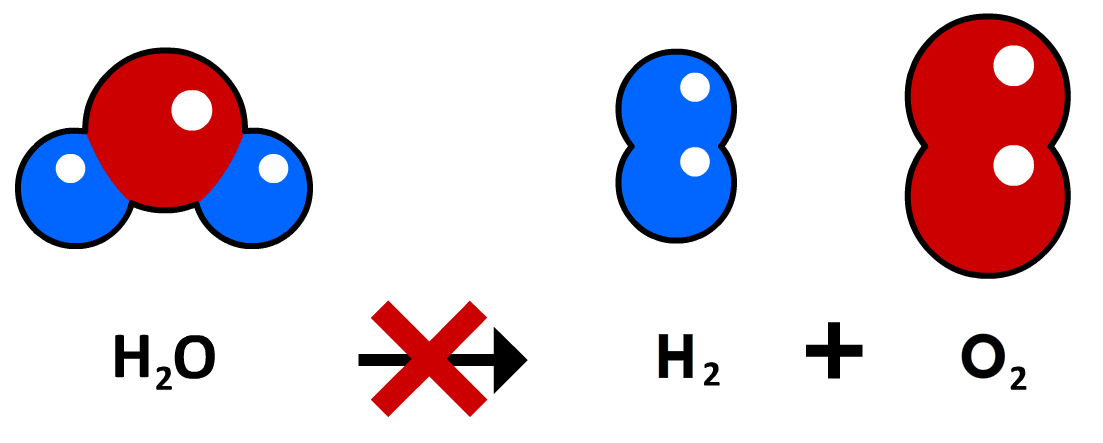
Deze reactievergelijking klopt echter niet, want het aantal atomen voor en na de reactie is niet gelijk. We kunnen dit probleem oplossen door coëfficiënten toe te voegen. Dit zijn de getallen die we voor molecuulformules schrijven om het aantal moleculen aan te geven. Hieronder is dit gedaan:
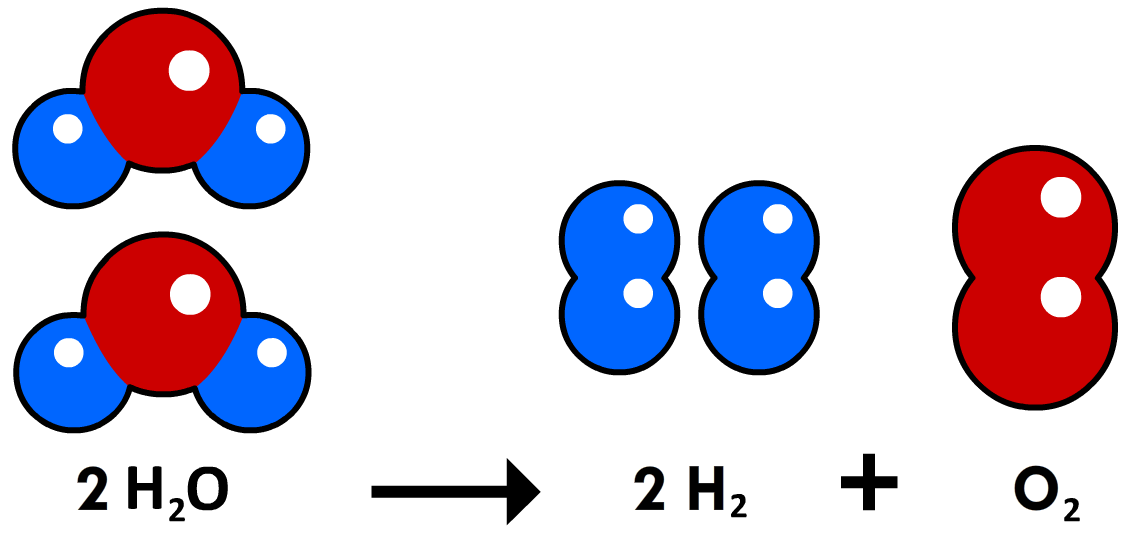
De reactievergelijking is nu kloppend gemaakt. Zoals je ziet hebben we aan zowel de linker- als de rechterzijde twee zuurstofatomen en vier waterstofatomen.
Merk ook op dat er bij deze reactie twee keer zoveel waterstof als zuurstof is ontstaan. Dit kunnen we experimenteel nagaan als we de elektrolyse van water daadwerkelijk uitvoeren. Als we elektriciteit door water laten lopen, dan ontstaat er inderdaad twee keer zoveel waterstof als zuurstof. Dit kun je zien in de onderste afbeelding, waar in de linker buis zuurstofgas is ontstaan en in de rechter buis waterstofgas.
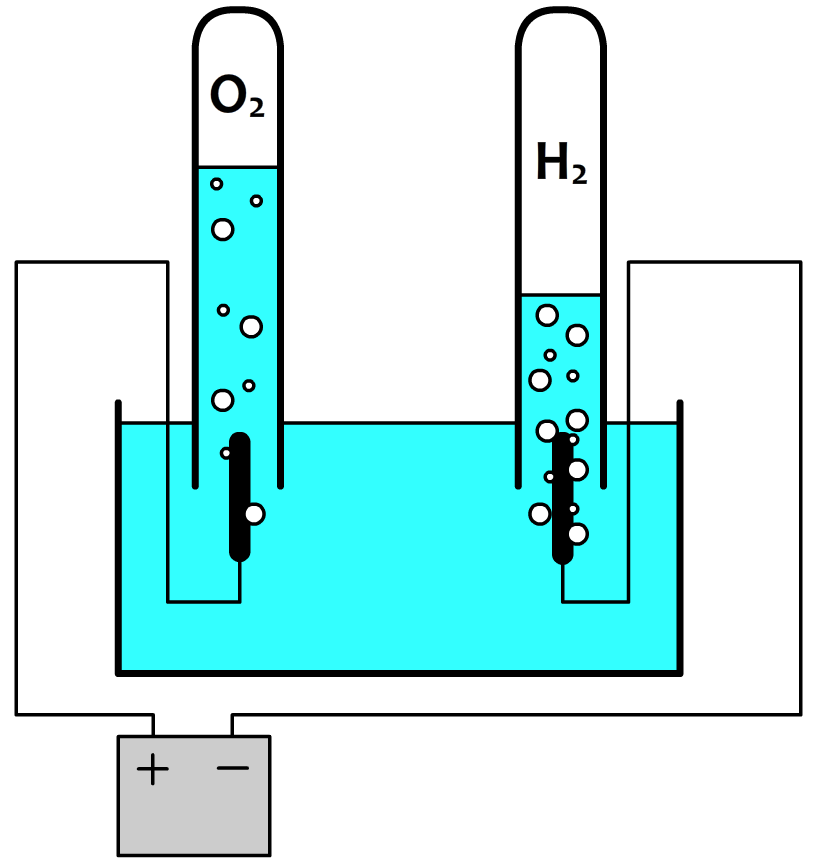
Beide gassen zijn transparant en kleurloos, dus we moeten nog aantonen dat het hier daadwerkelijk om zuurstof en waterstof gaat. Zuurstof kunnen we aantonen door een gloeiende houtspaander (een gloeiend stukje hout) in het buisje te steken nadat het buisje uit het water is gehaald. Door de aanwezigheid van pure zuurstof gaat het feller gloeien. Waterstof is een brandstof. Als we het buisje uit het water halen en een brandende lucifer bij de opening houden, dan vindt een kleine explosie plaatst met een karakteristiek "blafgeluid." Dit toont aan dat we met waterstof te maken hebben.
In het onderstaande voorbeeld wordt een lastigere reactievergelijking opgelost. Als het oplossen van reacties nieuw voor je is, dan is het misschien handig dit voorbeeld eerst met behulp van het filmpje onder aan de paragraaf door te nemen. Daarna wordt dit voorbeeld een stuk gemakkelijk te lezen.
 Voorbeeld
Voorbeeld
|
|
Vraag: Als ammoniak reageert met zuurstof, dan ontstaat stikstofdioxide en water. Noteer de reactieverlijking die bij deze reactie hoort. Antwoord: Ammoniak is NH3, zuurstof is O2, stikstofdioxide is NO2 en water is H2O. Een eerste poging tot een reactievergelijking wordt hiermee: $$ \text{... NH}_3 + \text{... O}_2 \rightarrow \text{... NO}_2 + \text{... H}_2\text{O} $$ Het is handig om bij het kloppend maken niet te starten met de atomen die aan dezelfde kant van de vergelijking meerdere keren voorkomen. In dit voorbeeld is dit het geval voor zuurstof, dat twee keer voorkomt aan de rechterzijde. Zuurstof gaan we pas als laatst kloppend maken. Laten we beginnen met bijvoorbeeld de waterstofatomen: $$ \text{2 NH}_3 + \text{... O}_2 \rightarrow \text{... NO}_2 + \text{3 H}_2\text{O} $$Nu hebben we aan beide kanten 6 waterstofatomen. Nu de stikstof: $$ \text{2 NH}_3 + \text{... O}_2 \rightarrow \text{2 NO}_2 + \text{3 H}_2\text{O} $$We hebben nu aan beide kanten 2 stikstofatomen. Dan de zuurstof. Aan de rechterkant hebben we in totaal 7 zuurstofatomen. Als we dit links ook willen hebben zouden we 3,5 O2 moleculen nodig hebben: $$ 2\text{NH}_3 + 3,5\text{O}_2 \rightarrow 2\text{NO}_2 + 3\text{H}_2\text{O} $$3,5 O2 is natuurlijk onzinnig. We lossen dit op door alle coëfficiënten in de reactie te verdubbelen: $$ 4\text{NH}_3 + 7\text{O}_2 \rightarrow 4\text{NO}_2 + 6\text{H}_2\text{O} $$Nu is de reactie kloppend (ga dit zelf maar na).
|
Leerdoelen:
| ||
|
§2 Verbrandingsreacties en neerslagreacties
In deze paragraaf gaan we nauwkeuriger kijken naar verbrandingsreacties, het winnen van metalen uit ertsen en neerslagreacties. We gaan deze reacties beschrijven met behulp van reactievergelijkingen zoals we dat in de vorige paragraaf geleerd hebben.
In deze paragraaf beginnen we met twee verbrandingsreacties die we kloppend gaan maken.
 Voorbeeld
Voorbeeld
|
|
Vraag: Noteer de reactievergelijking die hoort bij de volledige verbranding van aardgas. Antwoord: Aardgas bestaat uit het brandbare gas methaan (CH4). Als methaan volledig verbrandt in de aanwezigheid zuurstof (O2), dan ontstaan de stoffen water(H2O) en koolstofdioxide (CO2). Zorg dat je dit uit je hoofd weet. Een eerste poging van een reactievergelijking wordt hiermee: $$ \mathrm{... CH}_4 + \mathrm{... O}_2 \rightarrow \mathrm{... CO}_2 + \mathrm{... H}_2\mathrm{O} $$Nu maken we de reactie kloppend (zoals we in de vorige paragraaf geleerd hebben): $$ \mathrm{CH}_4 + 2 \mathrm{O}_2 \rightarrow \mathrm{CO}_2 + 2 \mathrm{H}_2\mathrm{O} $$Ga zelf na dat we alle atomen van voor de reactie ook na de reactie vinden.
|
 Voorbeeld
Voorbeeld
|
|
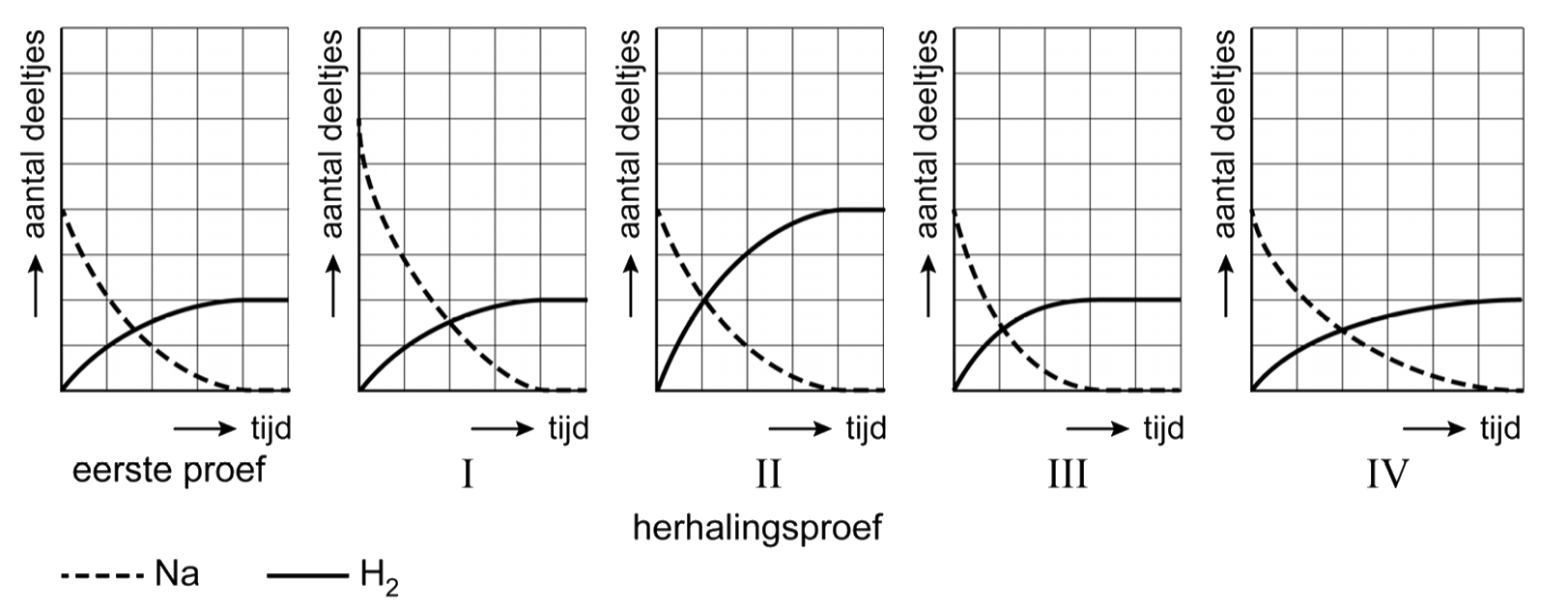
Vraag: Geef de reactievergelijking die hoort bij de verbranding van natrium. Antwoord: Bij elke verbranding is zuurstof (O2) nodig. Als natrium met deze zuurstof reageert ontstaat natriumoxide. In woorden is de reactievergelijking: $$ \mathrm{natrium} + \mathrm{zuurstof} \rightarrow \mathrm{natriumoxide} $$Natriumoxide bestaat uit een metaal- en een niet-metaalatoom en is dus een zout. Zouten bestaan uit ionen. In het periodiek systeem vinden we dat een natriumion een lading van 1+ heeft en een oxide-ion een lading van 2-. De verhoudingsformule wordt hiermee Na2O. De eerste poging tot een reactievergelijking wordt hiermee: $$ \mathrm{... Na} + \mathrm{... O}_2 \rightarrow \mathrm{... Na_2O} $$Merk op dat we het metaal natrium gewoon als "Na" hebben genoteerd. Metalen noteren we in reactievergelijkingen altijd als "losse atomen". Nu maken we de reactievergelijking kloppend: $$ \mathrm{4 Na} + \mathrm{O}_2 \rightarrow \mathrm{2 Na_2O} $$Ga zelf na dat de reactie klopt.
|
Nu gaan we het winnen van ijzer uit ijzererts beschrijven met reactievergelijkingen. IJzer halen we uit de natuur in de vorm van ijzererts (zie de onderstaande afbeelding).
 (Afbeelding: James St. John; CC BY 2.0)
(Afbeelding: James St. John; CC BY 2.0)
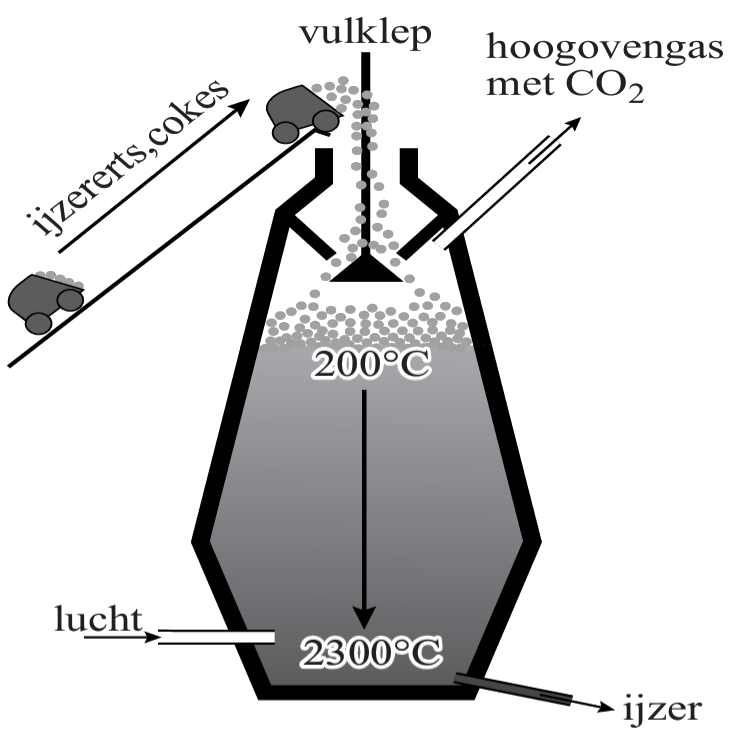
IJzererts bestaat met name uit ijzer(III)oxide. Dit bestaat uit de ionen Fe3+ en O2-. Omdat de stof neutraal moet zijn, vinden we hiermee de volgende verhoudingsformule: Fe2O3.
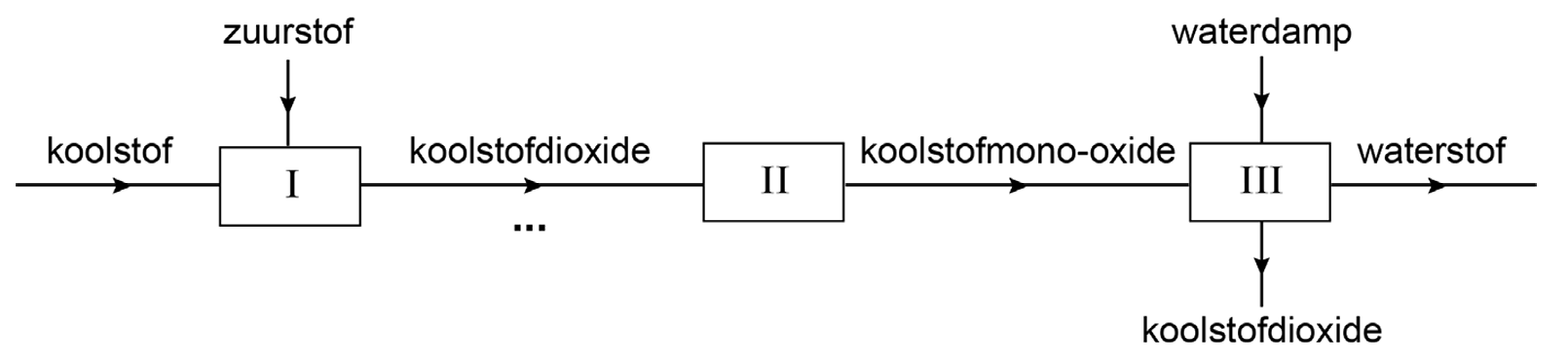
In zogenaamde hoogovens wordt hier ijzer (Fe) van gemaakt. Dit werkt als volgt. Eerst worden zogenaamde cokes, bestaande uit koolstof (C), met hete lucht verbrand. Hierbij ontstaat koolstofmonoxide (CO). Als we deze reactie uitschrijven, dan vinden we:
$$ \text{... C} + \text{... O}_2 \rightarrow \text{... CO} $$Deze vergelijking maken we als volgt kloppend:
$$ \text{2 C} + \text{O}_2 \rightarrow \text{2 CO} $$De koolstofmonoxide die hierbij ontstaat laten we reageren met ijzer(III)oxide:
$$ \text{... Fe}_2\text{O}_3 + \text{... CO} \rightarrow \text{... Fe} + \text{... CO}_2 $$Deze reactie maken we als volgt kloppend:
$$ \text{Fe}_2\text{O}_3 + \text{3CO} \rightarrow \text{2Fe} + \text{3CO}_2 $$Zoals je kan zien ontstaat bij dit proces het metaal ijzer.
Doordat er nog wat koolstof in het ijzer aanwezig is, is het verkregen materiaal vrij bros. Door de hoeveelheid koolstof terug te dringen tot zo'n 1 of 2 procent ontstaat de stof staal. Dit is veel sterker.
Laten we ook het winnen van aluminium bespreken. Aluminium wordt gewonnen uit aluminiumerts, wat ook wel bauxiet wordt genoemd. Dit bestaat met name uit aluminium(III)oxide. De verhoudingsformule die hierbij hoort is Al2O3 (ga dit zelf na). Om hier aluminium uit te winnen, moeten we het laten smelten. Daarna kan elektrolyse toegepast worden. De ontledingsreactie ziet er als volgt uit:
$$ \text{... Al}_2\text{O}_3 \rightarrow \text{... Al} + \text{... O}_2 $$Deze vergelijking maken we als volgt kloppend:
$$ \text{2 Al}_2\text{O}_3 \rightarrow \text{4 Al} + \text{3 O}_2 $$Vergeleken met het winnen van ijzer, kost deze reactie erg veel energie en dat maakt het winnen van aluminium relatief duur. Als gevolg is het vaak aantrekkelijk om aluminium te recyclen in plaats van het nieuw te maken uit bauxiet.
In het volgende voorbeeld bespreken we een neerslagreactie.
 Voorbeeld
Voorbeeld
| |||||||||
|
Vraag: Een leerling mixt een zilverfluoride- met en een kaliumsulfide-oplossing. Geef de reactievergelijking van de reactie die plaatsvindt. Antwoord: Zilverfluoride bestaat uit Ag+ en F-. Kaliumsulfide bestaat uit K+ en S2-. Met BINAS vinden we welke combinaties van deze ionen goed of slecht oplossen:
Zoals je kan zien, is alleen de combinatie Ag+ en S2- slecht oplosbaar. Deze stof zal dus neerslaan. De verhoudingsformule voor deze stof is Ag2S. De bijbehorende reactievergelijking is: $$ \text{... Ag}^+\text{(aq)} + \text{... S}^{2-}\text{(aq)} \rightarrow \text{... Ag}_2\text{S (s)} $$De vergelijking wordt als volgt kloppend: $$ \text{2Ag}^+\text{(aq)} + \text{S}^{2-}\text{(aq)} \rightarrow \text{Ag}_2\text{S (s)} $$Merk op dat de fluoride-ionen en de kaliumionen niet in de vergelijking genoemd zijn. Deze ionen blijven immers gewoon opgelost in het water en nemen dus niet deel aan de reactie.
|
Een oplosvergelijking kunnen we ook kloppend maken. Neem bijvoorbeeld het oplossen van calciumnitraat (Ca(NO3)2). Dit lost op in Ca2+- en NO3--ionen. De vergelijking wordt hiermee:
$$ \text{... Ca(NO}_3\text{)}_2\text{ (s)} \rightarrow \text{... Ca}^{2+}\text{ (aq)} + \text{... NO}_3^{-}\text{(aq)} $$Deze vergelijking maken we als volgt kloppend:
$$ \text{Ca(NO}_3\text{)}_2\text{ (s)} \rightarrow \text{Ca}^{2+}\text{ (aq)} + \text{2NO}_3^{-}\text{(aq)} $$
Leerdoelen:
| ||
|
§3 Reactiesnelheid
In deze paragraaf gaan we bestuderen hoe snel reacties verlopen.
In deze paragraaf gaan we bestuderen hoe snel reacties verlopen. De reactiesnelheid tussen twee stoffen hangt o.a. af van:
- De soort stoffen die reageren
- De concentratie van de stoffen
- De temperatuur
- De verdelingsgraad
- De aanwezigheid van een katalysator
De laatste drie punten hebben wat toelichting nodig. Laten we beginnen met de temperatuur. Hoe hoger de temperatuur van een stof, hoe sneller de deeltjes bewegen. De deeltjes botsen hierdoor vaker en de botsingen zijn ook krachtiger. Het resultaat is dat de reactiesnelheid omhoog gaat.
De verdelingsgraad vertelt ons hoe groot het contactoppervlak is tussen twee stoffen die met elkaar reageren. Neem als voorbeeld het verbranden van hout. Een groot blok hout heeft een relatief klein contactoppervlak en als gevolg is de reactiesnelheid laag. Een even groot volume aan houtsnippers daarentegen heeft een veel groter contactoppervlak. Dit verklaart waarom het gemakkelijker is om houtsnippers in brand te steken. In de onderstaande afbeelding wordt dit effect duidelijk. In de linker afbeelding komt zuurstof in aanraking met een blok met 16 centimeter aan omtrek. In de rechter afbeelding is het blok verdeeld in 16 stukken en komt zuurstof in aanraking met 64 centimeter aan omtrek. Dit is 4 keer zo veel!

Een katalysator is een stof die een reactie versnelt. Als voorbeeld bestuderen we de ontleding van waterstofperoxide (H2O2) in water en zuurstof:
$$ \mathrm{waterstofperoxide} \rightarrow \mathrm{water} + \mathrm{zuurstof} $$Deze reactie verloopt normaal gesproken extreem langzaam, maar als we de katalysator kaliumjodide toevoegen, dan verloopt de reactie veel sneller (zie het onderstaande filmpje):
Een eigenschap van katalysatoren is dat ze wel gebruikt worden tijdens een reactie, maar niet verbruikt. Na de reactie is er dus evenveel katalysator over als daarvoor en dit betekent dat we de katalysator dus kunnen hergebruiken.
In het menselijk lichaam bevinden zich ook katalysatoren die processen als de spijsvertering versnellen. Deze katalysatoren zorgen ervoor dat allerlei reacties plaats kunnen vinden die normaal alleen bij hoge temperaturen kunnen plaatsvinden. De katalysatoren in ons lichaam worden enzymen genoemd. Enzymen zijn grote moleculen met een speciale vorm waar andere moleculen precies in kunnen klikken (zie de onderstaande afbeelding). Nadat dit gebeurd is, kan het enzym het ingevangen molecuul bijvoorbeeld opdelen in twee kleinere moleculen.
 (Afbeelding: Biocyclopedia)
(Afbeelding: Biocyclopedia)
Leerdoelen:
| ||||
|
Stoffen die je uit je hoofd moet kennen:
|
Atomen |
|||
|
Metalen |
Niet-metalen |
||
|
Natrium |
Na |
Waterstof |
H |
|
Kalium |
K |
Koolstof |
C |
|
Magnesium |
Mg |
Stikstof |
N |
|
Calcium |
Ca |
Fosfor |
P |
|
Barium |
Ba |
Zuurstof |
O |
|
Chroom |
Cr |
Zwavel |
S |
|
IJzer |
Fe |
Fluor |
F |
|
Nikkel |
Ni |
Chloor |
Cl |
|
Platinum |
Pt |
Broom |
Br |
|
Koper |
Cu |
Jood |
I |
|
Zilver |
Ag |
Helium |
He |
|
Goud |
Au |
Neon |
Ne |
|
Zink |
Zn |
Argon |
Ar |
|
Cadmium |
Cd |
|
|
|
Kwik |
Hg |
||
|
Aluminium |
Al |
||
|
Tin |
Sn |
Metalloïde |
|
|
Lood |
Pb |
Silicium |
Si |
|
Moleculen |
|
|
Water |
H2O |
|
Waterstofperoxide |
H2O2 |
|
Koolstofdioxide |
CO2 |
|
Koolstofmonoxide |
CO |
|
Methaan |
CH4 |
|
Ammoniak |
NH3 |
|
Ethanol (alcohol) |
C6H12O |
|
Glucose |
C6H12O6 |
|
Edelgassen |
X |
|
Halogenen |
X2 |
|
Stikstof |
N2 |
|
Waterstof |
H2 |
|
Zuurstof |
O2 |
|
Ozon |
O3 |
|
Samengestelde ionen |
|
|
carbonaat-ion |
CO32- |
|
nitraat-ion |
NO3- |
|
sulfaat-ion |
SO42- |
|
fosfaat-ion |
PO43- |
|
hydroxide-ion |
OH- |
|
Ammonium-ion |
NH4+ |
|
Zouten |
||
|
Keukenzout |
Natriumchloride |
NaCl |
|
Kalkwater |
Calciumhydroxide |
Ca(OH)2 (aq) |
|
Kalksteen |
Calciumcarbonaat |
CaCO3 |
|
Soda |
Natriumcarbonaat |
Na2CO3 |
|
Natronloog |
Natriumhydroxide |
NaOH (aq) |
| BINAS: | |
| 33 | Elementen en symbolen |
| 34 | Periodiek systeem |
| 35 | Oplosbaarheid zouten |
| 42 | Triviale en rationele namen stoffen |