Hoofdstuk 1
Experimenteren
§1 Veiligheid §2 Experimenteren §3 Temperatuur §4 Chemische reacties en faseovergangen §5 Verbranding §6 Onderzoek
§1 Veiligheid
In dit hoofdstuk ga je leren hoe je scheikunde experimenten kan uitvoeren. In de scheikunde werken we vaak met chemicaliën. Voordat we gaan experimenteren met deze stoffen is het van belang dat je hier veilig mee om kan gaan. In deze paragraaf lees je hier meer over.
Ter bescherming van je kleding en je armen dragen we tijdens scheikunde-experimenten een labjas en ter bescherming van je ogen draag je een veiligheidsbril (zie de onderstaande afbeelding). Beide dien je ten alle tijden op te hebben als er in het lokaal scheikunde-experimenten worden uitgevoerd. Denk er tevens aan om lange haren met een elastiek in een knotje te binden. Je wilt immers niet dat je haren in een gevaarlijke stof of in een vlam belanden. Let er ook op dat je niet eet en drinkt in het scheikundelokaal, omdat stoffen via je handen in je eten kunnen gaan zitten. Om gevaarlijke stoffen niet onopgemerkt via je handen mee naar buiten te nemen, is het van belang je handen te wassen na afloop van een experiment.
Let er tevens op dat je veel stoffen die je gebruikt in de scheikundeles niet in de prullenbak of de gootsteen kan gooien. Dit geldt bijvoorbeeld voor stoffen die giftig zijn of schadelijk zijn voor het milieu. Vaak wordt dit verzameld in een speciaal afvalvat in het lokaal.
Mocht er toch iets misgaan tijdens een experiment, dan zijn er in het lokaal een aantal hulpmiddelen aanwezig. Als je een stof in je ogen krijgt, spoel je ogen dan zo snel mogelijk schoon met de oogdouche. Als je kleding in brand vliegt, ga dan onder de douche staan. Als er in het lokaal een brand ontstaat, dan kan je gebruik maken van de branddeken of de brandblusser. Gelukkig zijn deze noodmaatregelen zelden tot nooit nodig, maar mocht het een keer misgaan, dan is het belangrijk dat je weet wat je in zo’n situatie moet doen.
 (Afbeelding: TEDxNewcastle met Andrew Szydlo)
(Afbeelding: TEDxNewcastle met Andrew Szydlo)
Bij het gebruik van stoffen is het van belang eerst op het etiket te kijken naar de zogenaamde gevarenpictogrammen. Hieronder zie je een aantal pictogrammen waarvan je de betekenis uit je hoofd moet kennen. De pictogrammen staan ook in BINAS. In de onderstaande tabel zijn een aantal pictogrammen toegelicht.

|
Pictogram |
Betekenis |
|
Onder druk |
Een fles kan exploderen of de dop kan er hard afschieten als de fles te warm wordt. |
|
Schadelijk |
Deze stof is irriterend of schadelijk voor de huid en ogen of bij het inademen of inslikken. |
|
Corrosief |
Deze stof reageert bijtend op de huid en kan ook bepaalde materialen aantasten. |
|
Langetermijn-schade |
De schade bij deze stoffen is niet direct merkbaar, maar wel op lange termijn. Denk bijvoorbeeld aan kankerverwekkende stoffen. |
|
Ontvlambaar |
Deze stof kan gemakkelijk ontbranden. |
|
Oxiderend |
Deze stof kan andere stoffen gemakkelijk laten ontbranden of kan verbranding heftiger maken. |
Hiernaast zien we nog een laatste symbool. Dit symbool staat niet in BINAS, maar moet je toch kennen. Het symbool wil zeggen dat je de stof niet mag mengen met andere stoffen, bijvoorbeeld omdat dan giftige gassen vrij kunnen komen.

Ook belangrijk is de veiligheid van stoffen in ons voedsel. Als je op het etiket van voeding in de supermarkt kijkt, dan zie je daar vaak een hele lijst aan ingrediënten. Bij een aantal van deze ingrediënten staan E-nummers vermeld. Dit zijn hulpstoffen die door de Europese Unie zijn goedgekeurd er dus veilig worden geacht. Hiertoe behoren o.a. geurstoffen, smaakstoffen en kleurstoffen, en ook emulgeermiddelen (waardoor stoffen beter mengen), verdikkingsmiddelen (waarmee je een stof minder waterig maakt) en conserveringsmiddelen (waarmee voedsel langer houdbaar blijft). Deze E-nummers zijn ook te vinden in BINAS.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§2 Experimenteren
In deze paragraaf komen we dan eindelijk toe aan het uitvoeren van experimenten. In de theorie bespreken we een aantal materialen die we gebruiken bij experimenteren.
Als we stoffen willen mengen of verwarmen, dan doen we deze stoffen vaak eerst in glaswerk. Een bekend voorbeeld is de reageerbuis. Dit is een lang, dun, glazen buisje dat wordt gebruikt als we werken met kleine hoeveelheden stof (zie de onderstaande linker afbeelding). Door de onderkant van een reageerbuis rustig heen en weer te schudden (te kwispelen) kan je de stoffen die erin zitten voorzichtig mengen. Als harder schudden nodig is, kan je de reageerbuis dichtmaken met een rubberen stop (zie de rechter afbeelding). Met een reageerbuisknijper kan de reageerbuis opgepakt worden en in een vlam verhit worden.


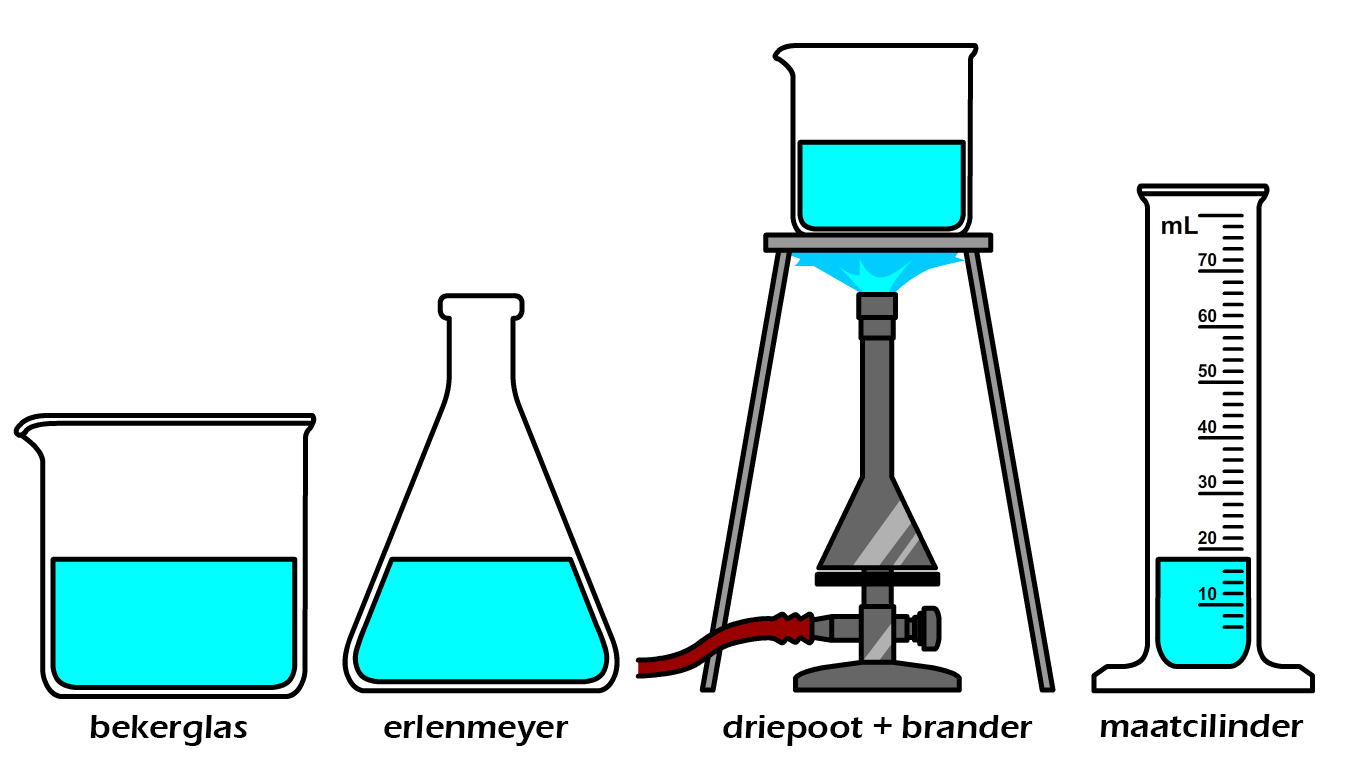
Een type glaswerk waar we meer stof in kwijt kunnen is het bekerglas (zie de eerste onderstaande afbeelding). Daarnaast hebben we ook de erlenmeyer (zie de tweede afbeelding). Een erlenmeyer heeft een brede bodem en een smalle hals en als gevolg kan je dit type glaswerk gemakkelijk schudden zonder te morsen. Zowel het bekerglas als de erlenmeyer kunnen ook verwarmd worden met een brander. Ze worden hiervoor eerst op een driepoot gezet (zie de derde afbeelding). Een ander type glaswerk is de maatcilinder (zie de vierde afbeelding). Een maatcilinder is een lange cilinder met op de zijkant een maatverdeling waarmee we het volume van vloeistoffen kunnen bepalen. Meestal wordt de maatverdeling gegeven in milliliters. Maatcilinders zijn niet bedoeld om te verwarmen.
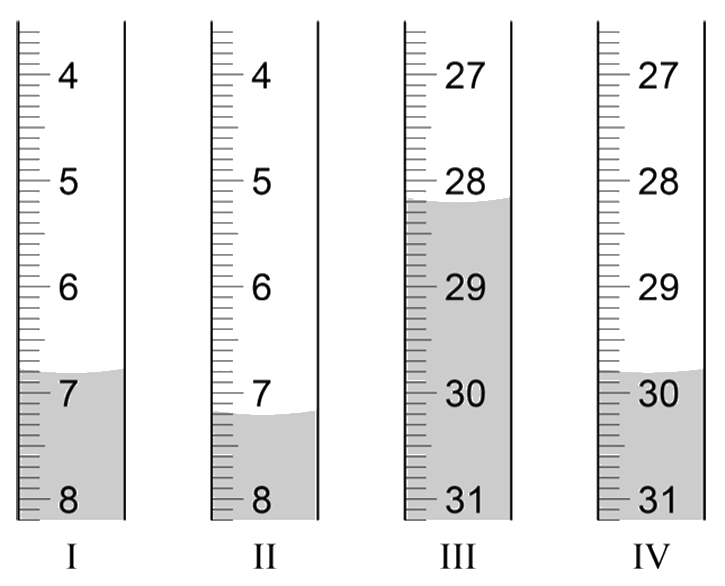
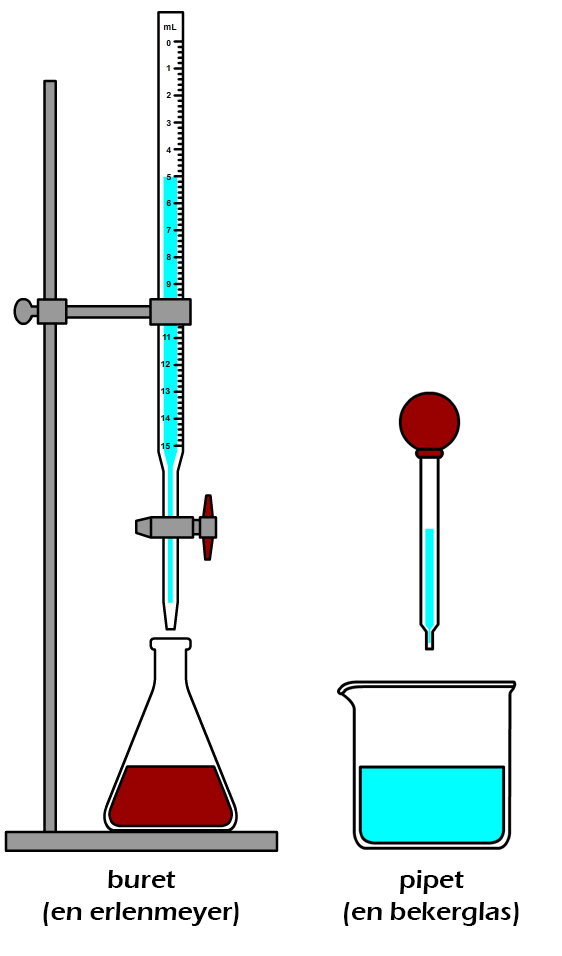
Hieronder zien we de links een buret. Door aan het kraantje onder aan de buret te draaien kan je gecontroleerd een bepaald volume vloeistof in bijvoorbeeld een erlenmeyer gieten. Merk op dat de schaalverdeling in dit geval van boven naar beneden loopt. Hiernaast is de buret tot de stand "5,0 mL" gevuld. Stel we laten de buret leeglopen tot "11,0 mL", dan hebben we 11,0 – 5,0 = 6,0 mL toegevoegd.
Rechts zien we een pipet. Dit is een klein glazen buisje met aan de bovenkant een rubberen ballonnetje. Als je de pipet in een vloeistof houdt en dan knijpt in het ballonnetje, dan vult de pipet zich met een beetje vloeistof. Deze vloeistof kan je dan op een andere plek weer loslaten.
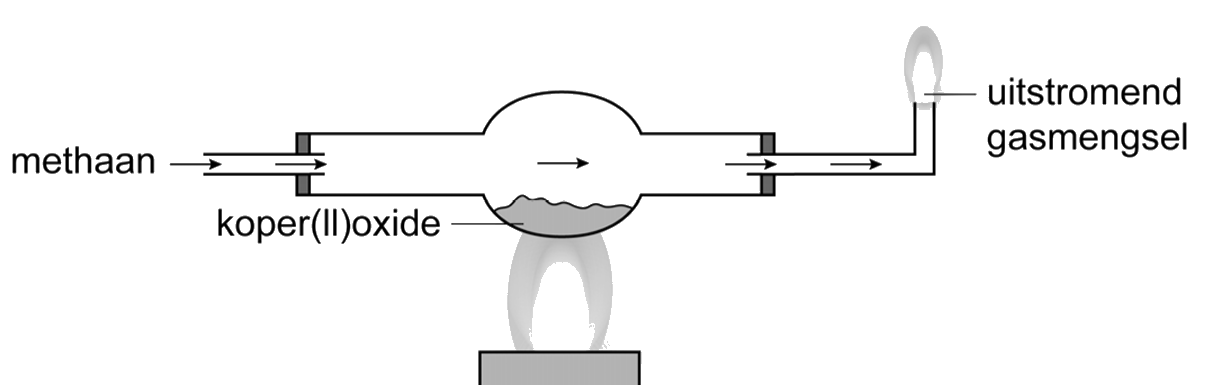
Om stoffen te verwarmen gebruiken we een gasbrander (zie de onderstaande afbeelding). De branders in het scheikundelokaal werken op aardgas. Dit gas bestaat voornamelijk uit het brandbare methaan (CH4). Dit gas is kleurloos en geurloos en daarom niet door mensen te detecteren. Omdat het gevaarlijk kan zijn als dit gas in een afgesloten ruimte ontsnapt, is een geur toegevoegd, zodat we het aardgas direct kunnen herkennen. Als we het aardgas met een lucifer aansteken, dan reageert het gas met de zuurstof in de lucht. Bij deze reactie komt warmte en licht vrij—er ontstaat vuur.
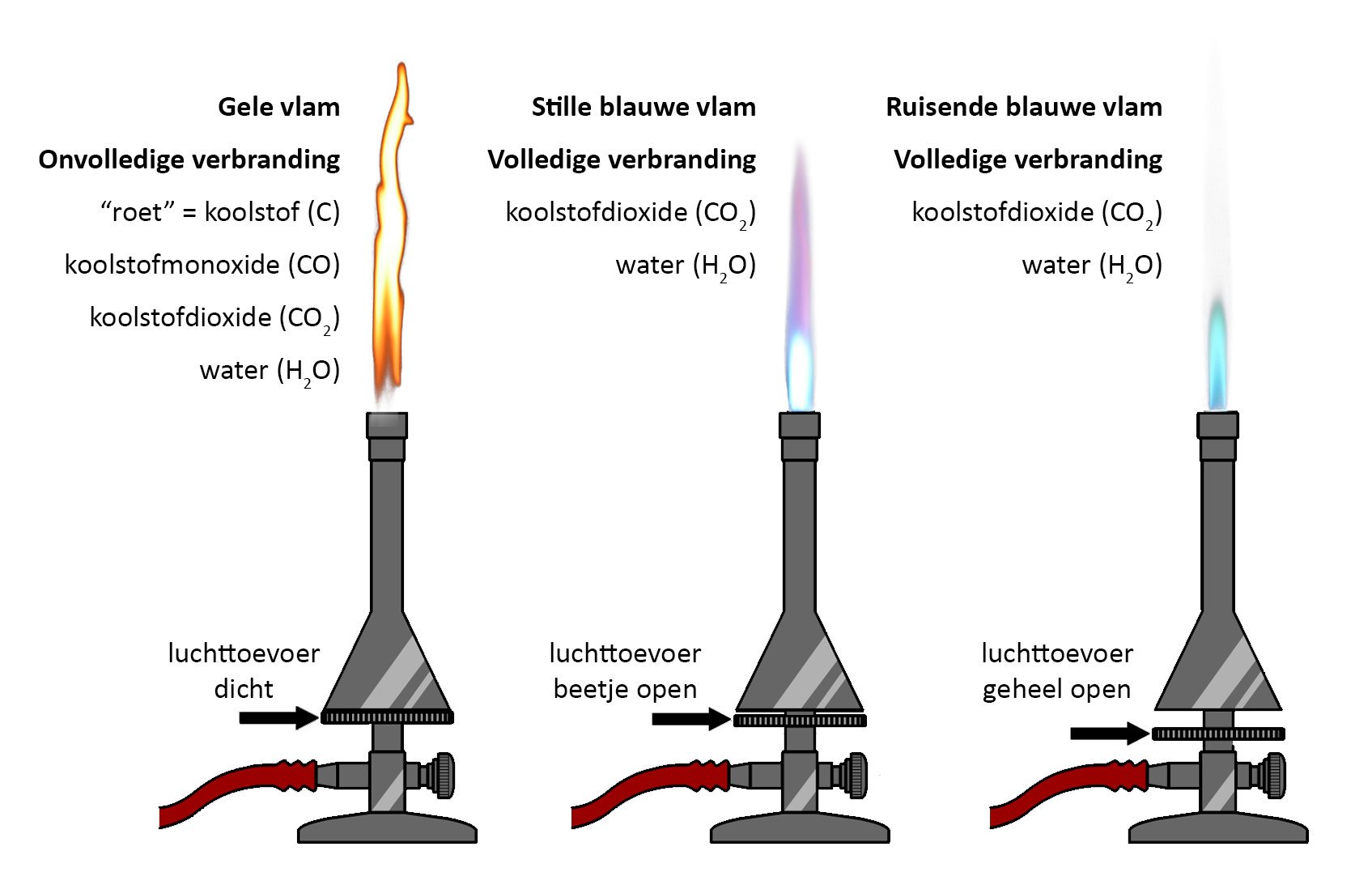
Als je met de gasbrander wilt werken, zorg je eerst dat de twee draaiknoppen van de brander dicht zijn. De onderste knop regelt de gastoevoer. Draai deze knop een beetje open en steek het gas met een lucifer aan. Als het goed is krijg je nu een gele vlam te zien. Door de gastoevoer nog verder open te draaien wordt de vlam groter.
 (Afbeelding: ... / Arthur Jan Fijalkowski; CC BY 3.0)
(Afbeelding: ... / Arthur Jan Fijalkowski; CC BY 3.0)
De bovenste knop regelt de luchttoevoer. Op dit moment is deze knop nog dicht en als gevolg kan er maar weinig zuurstof bij de vlam komen. We spreken in dit geval van onvolledige verbranding.
Bij dit type verbranding komt naast water (H2O) en koolstofdioxide (CO2) ook koolstof (C) en koolstofmonoxide (CO) vrij. Koolstofmonoxide is een onzichtbaar gas dat bij hoge concentratie gevaarlijk is voor de mens en zelfs dodelijk kan zijn.. Dit is waarom veel mensen in huis een koolstofmonoxidemelder hebben hangen. Koolstof is een zwarte vaste stof die we in het dagelijks leven "roet" noemen. Het ontstaan van roet merken we bijvoorbeeld als we een stukje glas in een gele vlam houden (zie de onderstaande afbeelding). Omdat we geen roet op ons glaswerk willen hebben, wordt een gele vlam niet gebruikt voor het verwarmen van materialen. Als we de brander even niet gebruiken, gebruiken we wel de gele vlam, omdat deze vlam het best zichtbaar is. De gele vlam wordt daarom ook wel de waarschuwingsvlam genoemd.
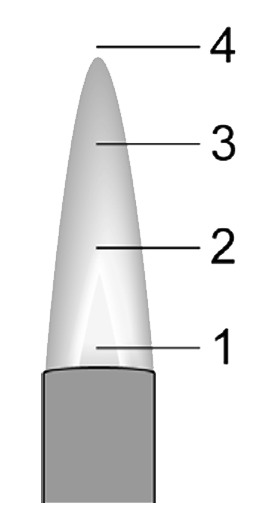
Als we stoffen willen verwarmen, dan zetten we de luchttoevoer verder open. Als we dit geleidelijk doen, zullen we eerst zien dat de vlam blauw wordt. Bij grote hoeveelheden zuurstof gaat de vlam daarnaast ook hoorbaar ruisen en wordt er een lichtblauwe kern in de vlam zichtbaar. We noemen deze vlammen de stille blauwe vlam en de ruisende blauwe vlam. De drie vlammen kan je in de onderstaande linker afbeelding zien. Hoe meer we de luchttoevoer openzetten, hoe heter de vlam wordt. Het topje van de lichtblauwe kern is het heetste deel van de vlam en daar worden dan ook materialen gehouden die we sterk willen verhitten.
Bij de blauwe vlam en de ruisende vlam vindt volledige verbranding plaats. Bij dit type verbranding ontstaat alleen koolstofdioxide (CO2) en waterdamp (H2O).
Waterdamp en koolstofdioxide zijn beide kleurloze en geurloze gassen. Ze zijn daardoor niet zichtbaar. We kunnen de aanwezigheid van deze stoffen wel aantonen met behulp van andere stoffen. De aanwezigheid van water of waterdamp kunnen we aantonen door het water te laten reageren met wit kopersulfaat. Deze stof krijgt na aanraking met water een blauwe kleur (zie de linker onderstaande afbeelding). Koolstofdioxide kan worden aangetoond door dit gas door helder kalkwater te laten stromen. Na aanraking met CO2 wordt deze vloeistof troebel wit (zie de onderstaande rechter afbeelding).

 (Afbeelding: Benjah-bmm27; PD / CaesiumFluoride; CC BY-SA 3.0)
(Afbeelding: Benjah-bmm27; PD / CaesiumFluoride; CC BY-SA 3.0)
 Demonstratievideo
Demonstratievideo
|
| In deze video's zie je de reactie tussen wit kopersulfaat en water. Hierbij wordt het witte kopersulfaat blauw. |
 EXPERIMENT
EXPERIMENT
| ||
|
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§3 Temperatuur
In deze paragraaf gaan we begrijpen wat temperatuur met stoffen doet. Het kan stoffen doen krimpen en uitzetten, kan de dichtheid veranderen en kan zorgen voor faseovergangen.
De temperatuur van een stof wordt veroorzaakt door de beweging van de deeltjes waaruit een stof bestaat. Hoe sneller deze deeltjes bewegen, hoe hoger de temperatuur van de stof.
 Demonstratievideo
Demonstratievideo
| ||
|
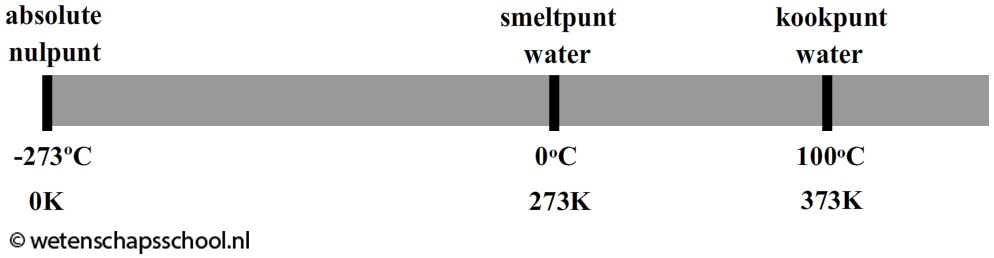
Andersom geldt ook dat hoe langzamer de deeltjes bewegen, hoe lager de temperatuur wordt. Als we een voorwerp blijven afkoelen, dan komt er een moment dat alle deeltjes stil staan. Dit gebeurt pas bij -273 °C. Op dat moment is de allerlaagste temperatuur bereikt. We noemen deze temperatuur het absolute nulpunt. Het is niet mogelijk dat een materiaal nog kouder wordt, want de deeltjes staan bij deze temperatuur immers al helemaal stil.
Sinds de ontdekking van het absolute nulpunt gebruiken we ook vaak de eenheid kelvin (K) voor de temperatuur. Het absolute nulpunt is bij deze schaal gelijkgesteld aan 0 K. Er geldt dus:
| $$ 0 \text{ K} = -273\,^{\circ}\text{C} $$ |
We rekenen kelvin en graden Celsius als volgt in elkaar om:
|
|
Als voorbeeld zien we in de onderstaande afbeelding het smeltpunt en het kookpunt van water. Water smelt bij 0 oC. Volgens de bovenstaande regel komt dit overeen met 0 oC + 273 = 273 K. Het kookpunt van water is 100 oC. Dit komt overeen met 100 oC + 273 = 373 K.
Er geldt ook dat hoe warmer een stof is, hoe harder de deeltjes elkaar wegduwen. Het materiaal neemt als gevolg meer ruimte in (zie de onderstaande animatie). Over het algemeen geldt daarom dat stoffen uitzetten als de temperatuur toeneemt en krimpen als de temperatuur weer afneemt.
Bij gassen kan je krimpen en uitzetten duidelijk zien. Als je een ballon met daarin lucht koud maakt door het bijvoorbeeld onder te dompelen in vloeibare stikstof, dan zie je de ballon duidelijk krimpen (zie het onderstaande filmpje). Als je de ballon daarna weer opwarmt, dan zet de ballon weer uit.

Bij het uitzetten van een stof neemt ook de dichtheid af. De dichtheid heeft weer invloed op drijven en zinken. Een stof met een lagere dichtheid drijft op een vloeistof of een gas met een hogere dichtheid.
 Demonstratievideo
Demonstratievideo
|
|
In het onderstaande filmpjes zien we dit effect in de praktijk: |
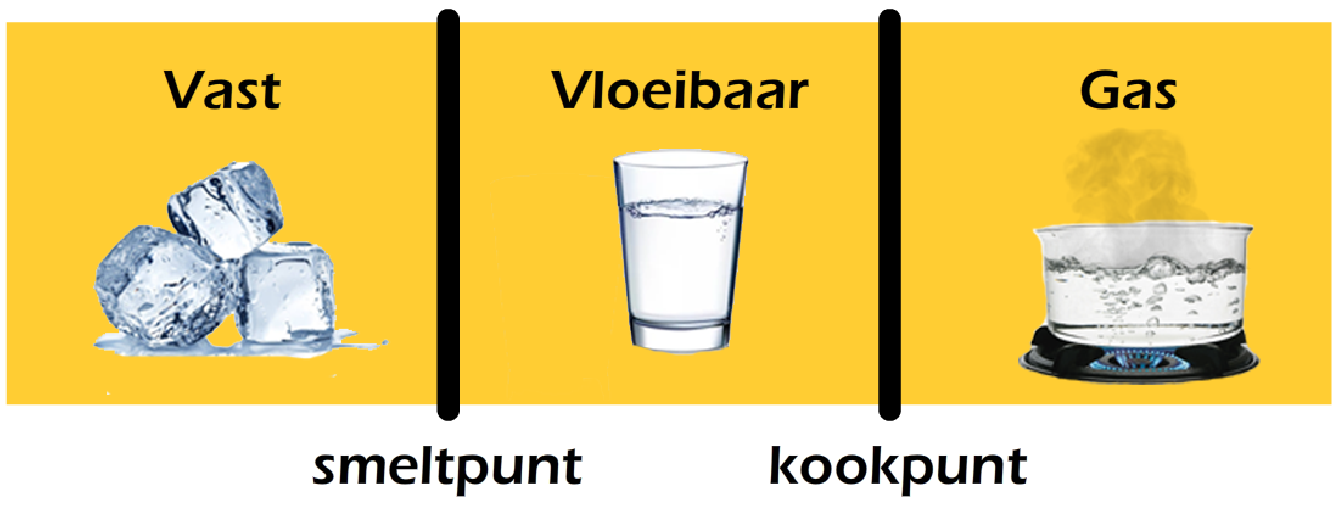
Met temperatuur kunnen we ook de verschillende fasen begrijpen. Stoffen bevinden zich meestal in één van de volgende drie fasen:
- Vast
- Vloeibaar
- Gas
In de scheikunde worden deze fasen aangegeven met de letters g ("gas)", l ("liquid" = vloeibaar) en s ("solid" = vast).
We kennen allemaal de drie fasen van water. Vast water noemen we ijs, vloeibaar water noemen we gewoon "water" en water in gasvorm noemen we waterdamp.
Een stof is vast als de temperatuur onder het smeltpunt ligt. Een stof is vloeibaar als de temperatuur tussen het smeltpunt en het kookpunt ligt en een stof is gasvormig als de temperatuur boven het kookpunt ligt (zie de onderstaande afbeelding).
Hieronder zijn de smelt- en de kookpunten van een aantal stoffen weergegeven. In BINAS kan je een uitgebreidere tabel vinden. Zoals je ziet zijn de temperaturen gegeven in kelvin. In de vorige paragraaf heb je geleerd dit om te rekenen naar graden Celsius:
|
Stof |
Smeltpunt |
Kookpunt |
|
Alcohol (ethanol) |
159 K |
351 K |
|
Benzine |
123 K |
- |
|
Ether |
157 K |
308 K |
|
Kwik |
234 K |
630 K |
|
Melk |
272 K |
373 K |
|
Olijfolie |
- |
570 K |
|
Petroleum |
203 K |
423 K |
|
Spiritus |
183 K |
351 K |
|
Water (277 K) |
273 K |
373 K |
|
Zeewater |
270 K |
- |
|
Zwavelzuur |
284 K |
603 K |
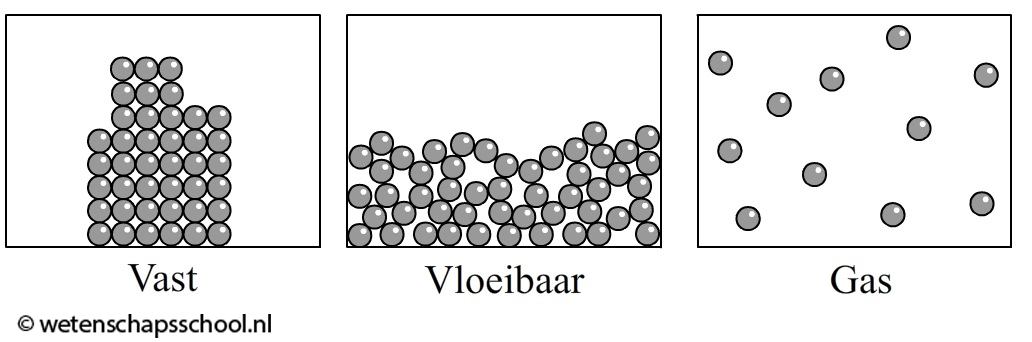
Ook de drie fasen kunnen we aan de hand van deeltjes begrijpen. In de onderstaande linker afbeelding is een vaste stof afgebeeld. De deeltjes in een vaste stof zitten op een vaste plaats en kunnen op deze plaats alleen een beetje heen en weer trillen. Alleen bij 0 K staan de deeltjes helemaal stil.
Bij een vloeistof zitten de deeltjes nog steeds tegen elkaar aan, maar hebben ze geen vaste plek meer. Ze kunnen nu vrij langs elkaar heen bewegen (zie de middelste afbeelding). Dit verklaart de beweeglijkheid van vloeistoffen.
In een gas zijn de deeltjes helemaal los van elkaar en vliegen kriskras door elkaar heen (zie de rechter afbeelding). Als een gas kleurloos is (wat bijvoorbeeld bij lucht het geval is), dan kan je het niet zien. De individuele deeltjes zijn immers te klein om met het oog waar te kunnen nemen.
 Demonstratievideo
Demonstratievideo
| ||
|
Als een stof van de ene fase overgaat naar een andere, dan spreken we van een faseovergang. Als een vloeistof in een vaste stof verandert, dan noemen we dit stollen (het stollen van water noemen we ook wel bevriezen). Als een vaste stof in een vloeistof verandert, dan noemen we dit smelten. Als een vloeistof in een gas verandert, dan noemen we dit verdampen en als een gas in een vloeistof verandert, dan noemen we dit condenseren (of condensatie).
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
| ||||||||||
|
§4 Chemische reacties en faseovergangen
In deze paragraaf gaan we het verschil tussen chemische reacties en natuurkundige processen bestuderen.
Scheikunde gaat over de eigenschappen van stoffen en wat er gebeurt als we deze stoffen mengen. In sommige omstandigheden kunnen stoffen veranderen in compleet andere stoffen. Als dit gebeurt, spreken we van een chemische reactie. Bijvoorbeeld een kleurverandering of een verbranding is een aanwijzing dat er een chemische reactie heeft plaatsgevonden.
Een bekend voorbeeld van een chemische reactie is de verbrandingsreactie. In de linker onderstaande afbeelding zien we de verbranding van staalwol. Staalwol bestaat voornamelijk uit ijzer en bij hoge temperaturen reageert het met de zuurstof in de lucht. Dit gebeurt bijvoorbeeld als je een batterij tegen staalwol aanhoudt. Bij de verbranding van ijzer ontstaat ijzeroxide. In het dagelijks leven noemen we dit ook wel "roest". Bij deze reactie is zuurstof en ijzer dus veranderd in een nieuwe stof: ijzeroxide. Er heeft dus een chemische reactie plaatsgevonden. In de natuur roest ijzer ook, maar dat gaat veel langzamer (zie de rechter afbeelding).

 (Afbeelding: alennzg / Islander61; CC BY-SA 4.0)
(Afbeelding: alennzg / Islander61; CC BY-SA 4.0)
Chemische reacties kunnen we beschrijven met een reactieschema. In een reactieschema schrijven we schematisch op welke stoffen voor de reactie aanwezig waren (de reactanten) en welke stoffen na de reactie zijn ontstaan (de producten):
$$ \mathrm{reactant} 1 + \mathrm{reactant} 2 + \mathrm{...} \rightarrow \mathrm{product} 1 + \mathrm{product} 2 + \mathrm{...} $$Laten we als voorbeeld de verbranding van staalwol nemen. Zoals we eerder gelezen hebben, reageert het ijzer waaruit staalwol bestaat met de zuurstof in de lucht en ontstaat er ijzeroxide. De reactanten zijn dus ijzer en zuurstof en het product is ijzeroxide. We schrijven dit op als:
$$ \mathrm{ijzer} + \mathrm{zuurstof} \rightarrow \mathrm{ijzeroxide} $$Een ander voorbeeld van een chemische reactie treedt op als we een stof genaamd carbid met water in bijvoorbeeld een melkbus stoppen en daarna aansteken. Bij het ontsteken schiet de dop van de melkbus soms meters ver weg en is een grote knal te horen en een vlam te zien (zie de onderstaande afbeelding en het onderstaande filmpje).
 (Afbeelding: Jjdez; CC BY-SA 3.0)
(Afbeelding: Jjdez; CC BY-SA 3.0)
 EXPERIMENT
EXPERIMENT
| ||
|
Bij het combineren van carbid en water ontstaan de stoffen ethyn en calciumhydroxide. Er geldt hier dus:
$$ \mathrm{carbid} + \mathrm{water} \rightarrow \mathrm{ethyn} + \mathrm{calciumhydroxide} $$Als we de stof ethyn aansteken, dan reageert het met de zuurstof in de lucht en ontstaat een explosie waarbij de gassen koolstofdioxide en waterdamp vrijkomen. Er geldt hier dus:
$$ \mathrm{ethyn} + \mathrm{zuurstof} \rightarrow \mathrm{koolstofdioxide} + \mathrm{waterdamp} $$In sommige delen van Nederland wordt rond de jaarwisseling carbid en water in een melkbus gedaan. Bij het ontsteken schiet de dop van de melkbus soms meters ver weg en is een grote knal te horen en een vlam te zien.
Het is belangrijk chemische reacties te kunnen onderscheiden van natuurkundige processen. Bij een natuurkundig proces verandert een stof, maar er ontstaat geen nieuwe stof en er is dan dus ook geen sprake van een chemische reactie. Een voorbeeld hiervan zijn faseovergangen. Denk bijvoorbeeld aan het smelten van ijs of het koken van water. Of je water nu in gas-, vloeibare- of vaste vorm tegenkomt, het blijft water. Bij een faseovergang ontstaat dus geen nieuwe stof en daarom is een faseovergang geen chemische reactie, maar een natuurkundig proces.
Een ander voorbeeld is het uitzetten of krimpen van een gas door dit gas te verwarmen of af te koelen. Als we bijvoorbeeld een ballon in extreem koud vloeibaar stikstof duwen, dan wordt het gas kouder en daardoor krimpt de ballon. Dit is ook een voorbeeld van een natuurkundig proces, want er ontstaan bij deze verandering geen nieuwe stoffen.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§5 Verbranding
In deze paragraaf gaan we bestuderen welke factoren nodig zijn voor verbranding.
Brand kunnen we herkennen aan vijf verbrandingsverschijnselen:
- Vlammen bestaan uit gloeiend gas (zie de linker onderstaande afbeelding).
- Roet is de zwarte stof genaamd koolstof (zie de tweede afbeelding).
- Rook bestaat uit zwevende vaste roetdeeltjes (zie de derde afbeelding).
- Vonken zijn kleine gloeiende deeltjes die wegschieten van een brandstof (zie de vierde afbeelding).
- Bij verbranding komt ook altijd warmte vrij, dit is een vorm van energie.

Een stof vliegt in brand als aan drie voorwaarden wordt voldaan. De eerste factor is de aanwezigheid van een brandstof, de tweede factor is de aanwezigheid van genoeg zuurstof en de derde factor is een temperatuur boven de ontbrandingstemperatuur. Deze drie voorwaarden zijn samengevat in de onderstaande verbrandingsdriehoek.

Misschien had je naast deze drie factoren ook verwacht dat het noodzakelijk zou zijn dat de brandstof "aangestoken" wordt. Dit is echter niet noodzakelijk. Als aan de bovenstaande drie eisen wordt voldaan, dan vliegt de stof automatisch in brand (dit zie je bijvoorbeeld gebeuren in het onderstaande filmpje). De vlam van een lucifer kan natuurlijk wel helpen om de ontbrandingstemperatuur te bereiken.
 EXPERIMENT
EXPERIMENT
| ||
|
Als we een brand willen blussen, dan kan dat door één of meerdere van de drie factoren weg te nemen. Als bijvoorbeeld olijfolie in een koekenpan in brand vliegt, dan is het voldoende om een deksel op de pan te plaatsen. Als gevolg raakt de zuurstof in de pan op en stopt de verbrandingsreactie (het is geen goed idee om water in een pan te gooien, want dan ontstaat een gevaarlijke steekvlam doordat hete oliedruppels opspatten).
De brandweer gebruikt vaak water om vuur te doven. Water helpt bij het blussen van een brand omdat het de brandstof afkoelt. Het zorgt ervoor dat de temperatuur van de brandstof onder de ontbrandingstemperatuur komt. Een andere mogelijkheid om een brand te blussen is met een CO2-brandblusser. De koolstofdioxide in de blusser duwt de zuurstof in de lucht weg bij het vuur en daardoor gaat het vuur uit. We zien dit effect in het onderstaande filmpje.
 EXPERIMENT
EXPERIMENT
| ||
|
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§6 Practicumverslag
In deze laatste paragraaf bespreken we de stappen van een goed onderzoek in de scheikunde.
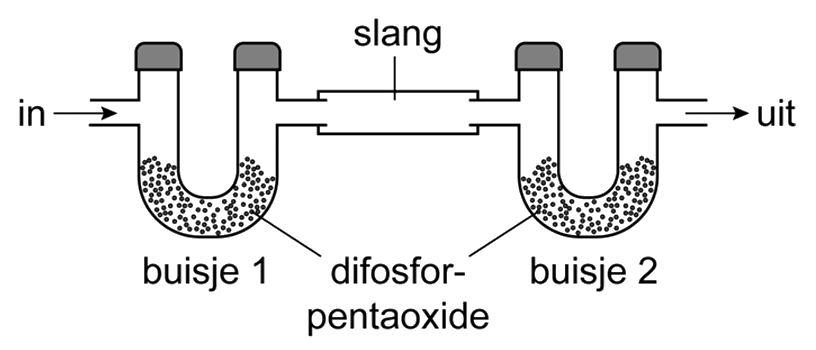
Als je onderzoek doet, dan is het van belang een onderzoeksvraag te formuleren. Stel we willen aantonen of er waterdamp vrijkomt bij de verbranding van aardgas. Een goede onderzoeksvraag is dan:
- Onderzoeksvraag: Komt er waterdamp vrij bij de verbranding van aardgas?
We kunnen deze vraag beantwoorden met een experiment. Na het uitvoeren van een experiment noteer je wat je gemeten en geobserveerd hebt. Dit worden ook wel waarnemingen genoemd.
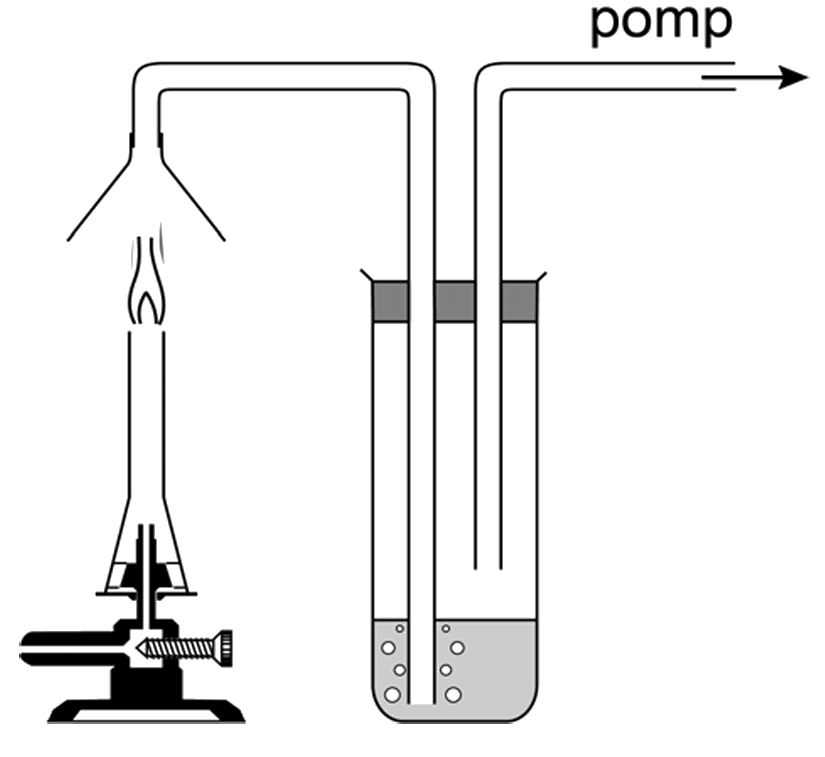
De aanwezigheid van waterdamp bij de verbranding van aardgas kunnen we bijvoorbeeld aantonen door de gassen die vrijkomen te laten reageren met wit kopersulfaat. Bij aanraking met water wordt deze witte stof namelijk blauw. We schrijven de waarneming dan als volgt op:
- Waarneming: Het witte kopersulfaat wordt blauw als het in aanraking komt met de gassen die vrijkomen bij de verbranding van aardgas.
Op basis van deze waarneming kunnen we een conclusie trekken. Met de conclusie laat je zien hoe je met de waarnemingen de onderzoeksvraag kan beantwoorden.
- Conclusie: Het witte kopersulfaat is blauw geworden. Als gevolg hiervan weten we dat er waterdamp is vrijgekomen bij de verbranding van aardgas.
Het komt vaak bij experimenten voor dat je niet met zekerheid een conclusie kan trekken. In dat geval moet het onderzoek verbeterd worden. In de discussie geef je aan wat er verbeterd moet worden.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
Stoffen die je uit je hoofd moet kennen:
|
Moleculen |
|
|
Water |
H2O |
|
Koolstofdioxide |
CO2 |
|
Koolstofmonoxide |
CO |
|
Methaan |
CH4 |
| BINAS: | |
| 1 | Omrekenen kelvin en graden Celsius |
| 15-17 | Dichtheid, smeltpunt en kookpunt van verschillende stoffen |
| 39 | Veiligheidspictogrammen |
| 40 | Informatie over gevaarlijke chemicaliën |
| 45 | E-nummers |