Hoofdstuk 8
Radioactiviteit (GEEN CE-STOF)
§1 De bouw van atomen §2 Kernverval §3 Halveringstijd §4 Stralingsgevaar en medische toepassingen
§1 De bouw van atomen
In dit hoofdstuk gaan we radioactiviteit bestuderen. Ook gaan we kijken naar de gevaren van radioactiviteit en gaan we een aantal medische toepassingen bespreken. Voordat we dit alles kunnen begrijpen, moeten we eerst atoomkernen bestuderen. Dat gaan we in deze eerste paragraaf doen.
In een eerder hoofdstuk hebben we geleerd dat materie is opgebouwd uit atomen. Atomen blijken ook weer opgebouwd uit kleinere deeltjes. Elk atoom heeft in zijn centrum een atoomkern, bestaande uit positief geladen deeltjes die we protonen noemen en neutrale deeltjes die we neutronen noemen. Om de kern heen bevindt zich een wolk van negatieve geladen deeltjes die we elektronen noemen. Elk atoom bevat evenveel protonen als elektronen en als gevolg zijn atomen neutraal.
Hieronder zien we de acht lichtste atomen. Waterstof (H) bestaat uit één proton en dus ook één elektron. Helium (He) bestaat uit twee protonen en dus ook twee elektronen. Lithium (Li) bevat drie protonen en dus ook drie elektronen. Etc.

Het aantal protonen in een atoom noemen we het atoomnummer. Deze nummers staan genoteerd in het zogenaamde periodiek systeem (zie de onderstaande afbeelding). Je kan deze tabel ook in BINAS vinden. In deze tabel zien we afkortingen van alle atomen, ook wel de symbolen genoemd. Linksonder de symbolen kan je bij elk atoom het atoomnummer vinden. Het is belangrijk te onthouden dat voor elke atoomsoort het atoomnummer vast staat. IJzer (Fe) heeft bijvoorbeeld altijd atoomnummer 26 (ga dit zelf na!).
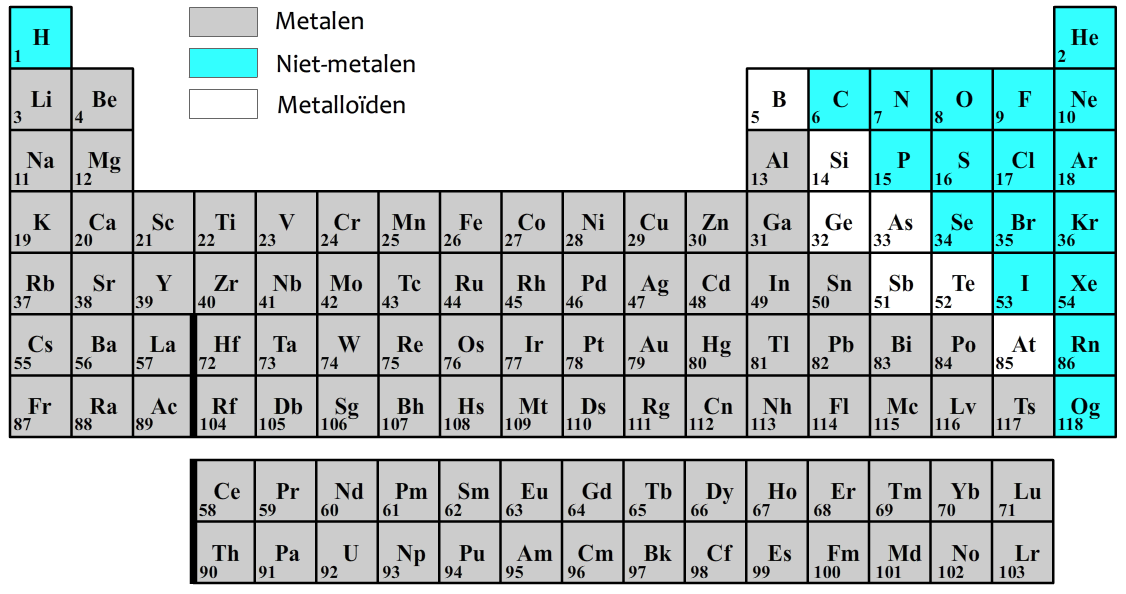
Het aantal protonen en neutronen samen noemen we het massagetal. Het massagetal wordt vaak achter de naam van het element genoemd. Fluor-19 heeft dus een massagetal van 19. Omdat fluor volgens het bovenstaande periodiek systeem 9 protonen heeft, moet het dus ook nog 10 neutronen bevatten, zodat het aantal protonen en neutronen samen 9 + 10 = 19 wordt. Waterstof-1 heeft een atoomnummer van 1 en bevat dus slechts 1 proton. Het massagetal van waterstof is ook 1, dus waterstof bevat 0 neutronen (omdat 1 + 0 = 1).
Het massagetal wordt ook geregeld linksboven het symbool van het element genoteerd. Het atoomnummer en massagetal schrijven we dan als volgt op:
$$^{\;\;\;\text{ massagetal}}_{\text{atoomnummer}}\text{Symbool}$$Het massagetal van een atoomsoort staat niet vast. Zo heb je bijvoorbeeld koolstof-12 en koolstof-14. In het periodiek systeem kunnen we zien dat koolstof altijd 6 protonen in de kern heeft. Om op het juiste massagetal uit te komen moet koolstof-12 nog 6 neutronen in de kern hebben (want 6 + 6 = 12) en moet koolstof-14 nog 8 neutronen in de kern hebben (want 6 + 8 = 14). Atomen met hetzelfde aantal protonen, maar met een verschillend aantal neutronen noemen we isotopen. Koolstof-12 en koolstof-14 zijn dus twee isotopen van koolstof.
$$^{12}_{\;6}C \;\;\;\;\;\; ^{14}_{\;6}C$$Ook het proton, het neutron en het elektron kunnen we in deze notatie opschrijven (zie het onderstaande kader). Het proton bestaat uit 1 proton en 0 neutronen, dus het atoomnummer is 1 en het massagetal is ook 1. Het neutron bestaat uit 0 protonen en 1 neutron, dus het atoomnummer is 0 en het massagetal is 1. Het elektron vormt een uitzondering op de regel. Een elektron bevat natuurlijk 0 protonen, maar omdat het een lading van -1 heeft, zeggen we dat het atoomnummer -1 heeft. Het massagetal van een elektron is 0. Het is belangrijk dat je dit uit je hoofd weet.
| $$^1_1p \;\;\;\;\;\;\;\; ^1_0n \;\;\;\;\;\;\;\; ^{\;\;0}_{-1}e$$ |
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§2 Kernverval
Nu we begrijpen waaruit atomen bestaan, kunnen de radioactiviteit begrijpen. We doen dit aan de hand van het begrip kernverval.
We spreken van een kernreactie als de atoomkern een verandering ondergaat. Een voorbeeld van een kernreactie is kernverval. Dit is het spontaan uit elkaar vallen van een atoomkern. Stoffen waarbij dit gebeurt noemen we radioactief. Bij kernverval schiet er vaak een deeltje met behoorlijke snelheid uit de atoomkern weg. We noemen dit straling. Als een atoom straling uitgezonden heeft, dan zeggen we dat het atoom vervallen is. De oorspronkelijke radioactieve kern noemen we de moederkern en de kern die na de straling overblijft noemen we de dochterkern. In sommige gevallen zijn de dochterkernen zelf ook weer radioactief. Er bestaan ook atoomkernen die geen straling uitzenden. We noemen deze isotopen stabiel.
Er kunnen bij kernreacties drie soorten straling vrijkomen. Welk type straling wordt uitgezonden door welke isotoop kan je vinden in BINAS.
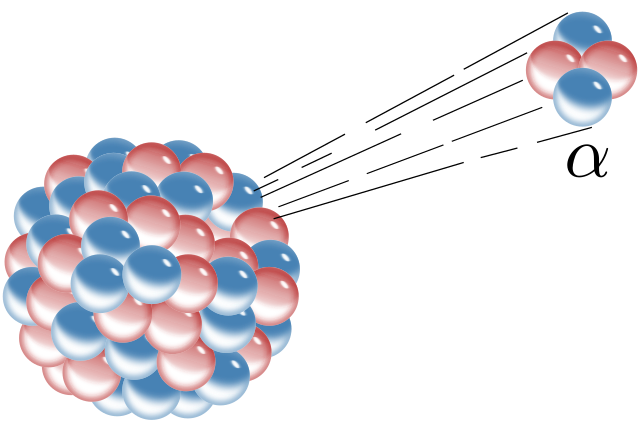
Alfastraling
De eerste soort wordt alfastraling pf α-straling genoemd. Hierbij breekt een helium-4-kern af van de kern van een atoom (zie de onderstaande afbeelding). Een helium-4-kern bevat twee protonen en twee neutronen:
| $$^4_2He \;\;\;\;\;\;\;\; (\alpha)$$ |
Laten we als voorbeeld het verval van de stof uranium-235 bestuderen. Volgens BINAS is uranium-235 een α-straler. We schrijven het verval van uranium-235 uit met een zogenaamde vervalvergelijking. In deze vergelijking schrijven we voor de pijl de stof die vervalt en achter de pijl de stoffen die na het verval zijn ontstaan. Omdat uranium-235 een alfastraler is, weten we in ieder geval dat er helium-4 is ontstaan:
$$ ^{235}_{92}\text{U} \rightarrow ... + ^{4}_{2}\text{He} $$Zoals je ziet is de dochterkern die ontstaat nog onbekend. Om hier achter te komen gebruiken we het volgende. De som van de atoomnummers voor de reactie moet gelijk zijn aan de som van de atoomnummers na de reactie. Hetzelfde geldt voor de massagetallen. Dit komt doordat de hoeveelheid massa en lading voor en na de reactie gelijk blijft. We vinden hiermee:
$$ ^{235}_{92}\text{U} \rightarrow ^{231}_{90}... + ^{4}_{2}\text{He} $$Zoals je ziet heeft de onbekende dochterkern atoomnummer 90 en massagetal 231. In BINAS kunnen we nu opzoeken welke stof hoort bij het atoomnummer 82. We vinden hier thorium (Th). De vergelijking wordt dus:
$$^{235}_{92}\text{U} \rightarrow ^{231}_{90}\text{Th} + ^{4}_{2}\text{He}$$Bètastraling
De tweede soort straling is bètastraling, ook wel β-straling of β--straling genoemd. Er komt in dat geval een elektron uit de atoomkern (zie de onderstaande afbeelding).
| $$^{\;\;0}_{-1}e^- \;\;\;\;\;\;\;\; (\beta^- \; \text{of} \;\; \beta)$$ |

Maar hoe kan er een elektron uit de kern komen? In sommige gevallen kan een neutron vervallen in een proton. Hier komt dan een elektron bij vrij:
$$^{1}_{0}\text{n} \;\rightarrow\; ^{1}_{1}\text{p} \;+\; ^{0}_{-1}\text{e}^-$$Laten we als voorbeeld het verval van stikstof-13 bestuderen. Volgens BINAS komt hier β--straling bij vrij:
$$ ^{13}_{7}\text{N} \;\rightarrow\; ... \;+\; ^{0}_{-1}\text{e}^- $$Ook hier moeten de atoomnummers en de massagetallen voor en na de reactie gelijk blijven. Houd er hier rekening mee dat het atoomnummer van het elektron -1 is. We vinden hiermee:
$$ ^{13}_{7}\text{N} \;\rightarrow\; ^{13}_{8}... \;+\; ^{0}_{-1}\text{e}^- $$De onbekende dochterkern heeft dus een atoomnummer van 8 en een massagetal van 13. In BINAS kunnen we nu opzoeken welke stof hoort bij het atoomnummer 13. We vinden hier zuurstof (O):
$$^{13}_{7}\text{N} \;\rightarrow\; ^{13}_{8}\text{O} \;+\; ^{0}_{-1}\text{e}^-$$Gammastraling
De laatste soort straling is gammastraling (γ-straling). Gammastraling bestaat uit lichtdeeltjes, ook wel fotonen genoemd, met een frequentie buiten het zichtbare spectrum. We schrijven:
| $$^0_0\gamma$$ |
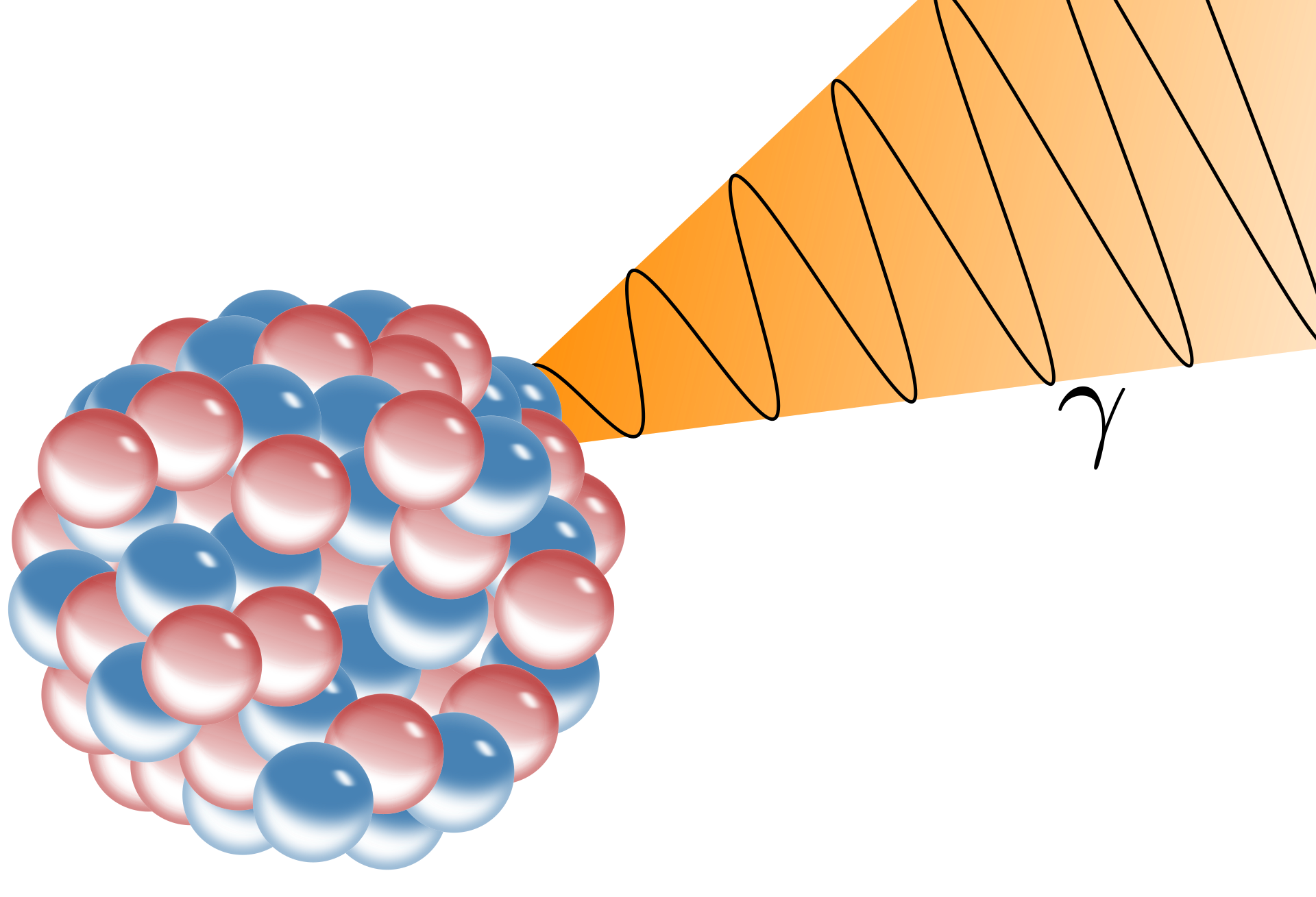
Zoals je ziet heeft een foton geen atoomnummer en ook geen massagetal. Als een atoomkern gammastraling uitzendt, verandert het atoomnummer en het massagetal dus niet. De kern raakt dan alleen wat energie kwijt. Als voorbeeld zien we hier het verval van technetium (Tc):
$$^{99}_{43}\text{Tc} \;\rightarrow\; ^{99}_{43}\text{Tc} \;+\; ^{0}_{0}\gamma $$
 Demonstratievideo
Demonstratievideo
| ||
|
 Demonstratievideo
Demonstratievideo
| ||
|
Kernsplijting
Tot nu toe hebben we het gehad over reacties die spontaan plaatsvinden. We kunnen kernreacties echter ook kunstmatig opwekken. Een voorbeeld is het beschieten van een uraniumatoom met een neutron. Het neutron wordt dan ingevangen door de kern, waarna de kern in een aantal stukken uiteenvalt. We noemen dit ook wel kernsplijting:
$$^{235}_{\;92}\text{U} \;+\; ^1_0\text{n} \;\rightarrow \;^{99}_{42}\text{Mo} \;+\; ^{134}_{\;50}\text{Sn} + 3^1_0\text{n}$$Zoals je kunt zien komen bij deze reacties weer nieuwe neutronen vrij en deze neutronen kunnen weer tegen andere uraniumatomen botsen. Als gevolg kan een kettingreactie op gang gebracht worden waarbij heel veel energie vrijkomt. Een gecontroleerde versie van zo'n kettingreactie vindt plaats in een kernreactor waar deze energie gebruikt wordt om elektriciteit op te wekken (en een ongecontroleerde versie bij het ontploffen van een kernbom).
 (Afbeelding: Emoscopes; CC BY-SA 3.0 / Bjoern Schwarz; CC BY 2.0)
(Afbeelding: Emoscopes; CC BY-SA 3.0 / Bjoern Schwarz; CC BY 2.0)
Naast kernverval bestaat ook kernfusie. Hier fuseren atoomkernen samen. Ook bij dit proces kan energie vrijkomen. Dit gebeurt bijvoorbeeld in de zon. Hier wordt waterstof gefuseerd tot helium. De energie die hierbij vrijkomt zorgt voor het licht dat de zon geeft.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
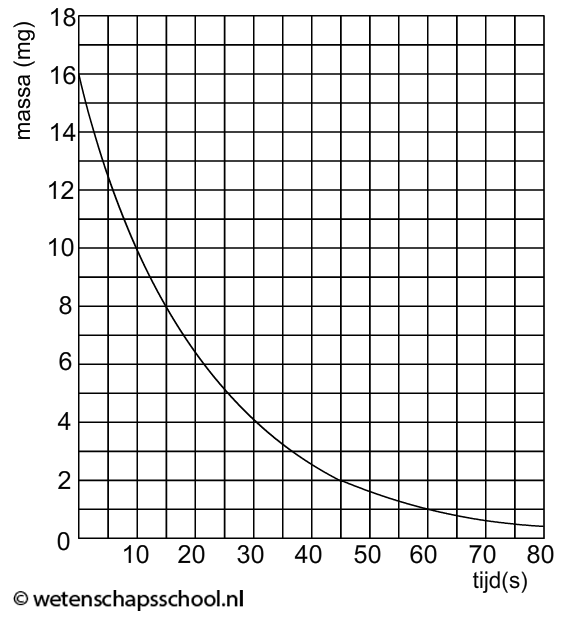
§3 Halveringstijd
In deze paragraaf gaan we bestuderen hoe het aantal radioactieve deeltjes in een bron afneemt in de tijd. We gebruiken hiervoor het begrip halveringstijd. Dit is de tijdsduur waarna de helft van de radioactieve atoomkernen vervallen is.
In de vorige paragraaf hebben we gezien dat radioactieve atoomkernen naar verloop van tijd straling uitzenden. Als dit gebeurd is, dan zeggen we dat het atoom vervallen is. De tijdsduur waarna de helft van de deeltjes in de bron vervallen is, noemen we de halveringstijd of de halfwaardetijd (t1/2).
In het onderstaande (N,t)-diagram zien we het aantal radioactieve deeltjes in een bron (N) uitgezet tegen de tijd (t). In dit geval zien we dat het aantal radioactieve kerndeeltjes elke 10 uur halveert. Voor deze bron geldt dus een halveringstijd van 10 uur.
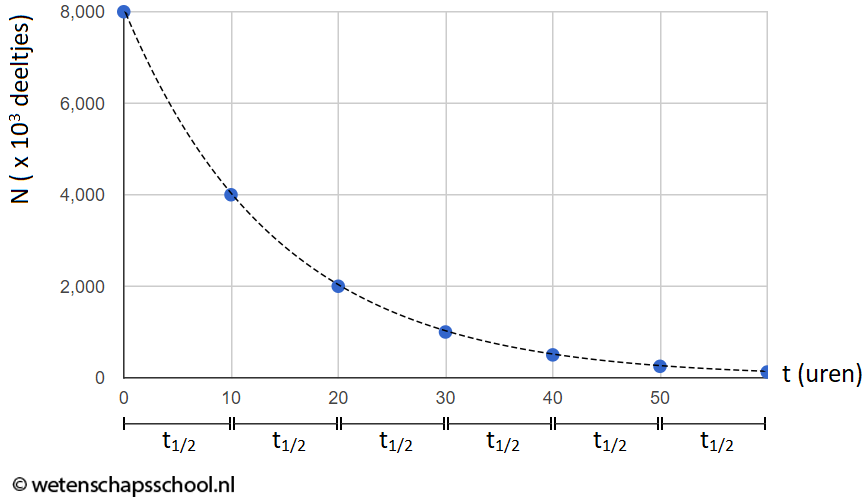
In het onderstaande programma zien we hoe deze grafiek zijn vorm krijgt. Elke keer als je op de knop "+1 halfwaardetijd" klikt, heeft elk deeltje (aangegeven met een zwarte cirkel) 50% kans om te vervallen. Als het deeltje vervallen is, wordt de cirkel wit.
Elke radioactieve isotoop heeft zijn eigen halveringstijd en deze kan variëren van een fractie van een seconde tot miljoenen jaren. Voor een aantal isotopen is de halveringstijd te vinden in BINAS. In deze tabel vinden we bijvoorbeeld dat koolstof-14 een halveringstijd heeft van 5730 jaar. Na 5730 jaar is dus nog maar 50% van de koolstof-14 over. Na 2 × 5730 = 11 460jaar is nog slechts 25% over en na 3 × 5730 = 17 190 jaar nog 12,5%. Etc.
Stel we hebben 20 gram van een radioactieve stof. Als we wachten tot bijvoorbeeld drie keer de halveringstijd van de stof voorbij is gegaan, dan is de 20 gram dus drie maal gehalveerd. We kunnen dan als volgt uitrekenen hoeveel gram we over houden:
$$ 20 \text{ gram} \;/\; 2 \;/\; 2 \;/\; 2 = 2,5 \text{ gram}$$Met het aantal halveringen (n) en de halveringstijd (t1/2) kunnen we uitrekenen hoelang deze halveringen geduurd hebben:
$$ t = t_{1/2} \times n $$
|
Het is in deze formule niet nodig om de tijd en de halveringstijd in seconden in te vullen. Je kan ook bijvoorbeeld dagen of jaren gebruiken.
De halveringstijd van stoffen kan o.a. gebruikt worden voor radiometrische datering. Dit is een techniek die gebruikt wordt om uit te vinden hoe oud voorwerpen zijn. Het bekendste voorbeeld hiervan is C14-datering. Koolstof-14 komt in vergelijking met andere koolstofisotopen in elk levend organisme in een vaste verhouding voor. Door te kijken hoeveel koolstof-14 er over is, kunnen we met de halveringstijd uitrekenen hoe lang geleden het organisme gestorven is. Stel dat in een oud houten beeldje slechts 6,25% van de C-14 deeltjes is overgebleven. Het aantal halveringen vind je dan door 100% telkens met 1/2 te delen door 2 tot je op de 6,25% uitkomt:
$$ 100\% \;/\; 2 \;/\; 2 \;/\; 2 \;/\; 2 = 6,25 \% $$De 6,25% wordt dus behaald na 4 halveringen (n).
Zoals eerder genoemd is de halveringstijd (t1/2) van C-14 gelijk aan 5730 j. Hiermee kunnen we nu uitrekenen hoe oud het beeldje moet zijn:
$$t = t_{1/2} \times n $$ $$t = 5730 \times 4 = 22\; 920 \text{ jaar}$$In dit geval blijkt het deeltje uit de Oude Steentijd te komen!
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§4 Stralingsgevaar en medische toepassingen
In deze paragraaf bestuderen we de gevaren van straling voor de mens. Ook bespreken we de positieve toepassingen van straling in het ziekenhuis.
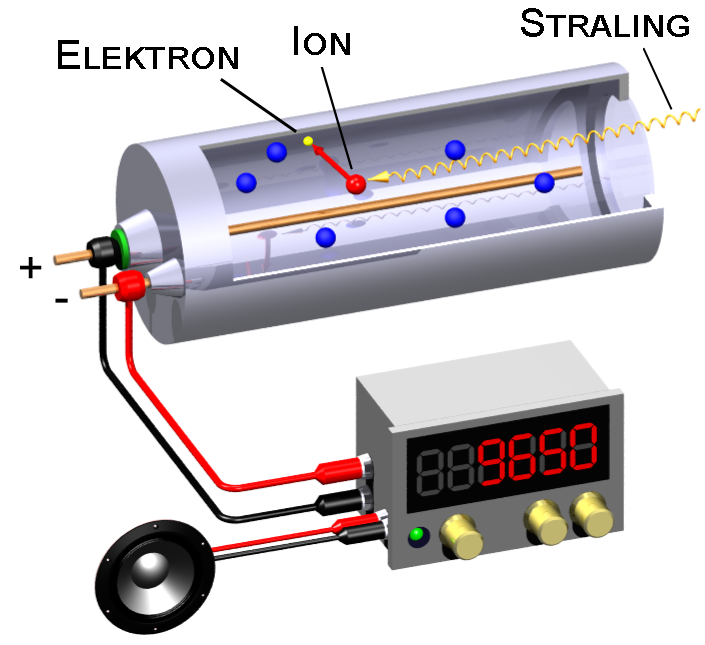
Radioactieve deeltjes vind je overal om je heen. Ze zitten niet alleen in gesteentes in gebergten, maar ook in de muren van ons huis en zelfs in ons eten. Gelukkig gaat het in deze gevallen meestal om kleine hoeveelheden. We kunnen aantonen of een stof radioactief is met een geigerteller (zie de onderstaande afbeelding). Dit apparaat bestaat uit een buis met daarin een gas. Als straling het gas binnenkomt, dan worden een aantal atomen van het gas geïoniseerd. Dit betekent dat de atomen elektronen kwijtraken. De vrijgemaakte elektronen zorgen dan voor een kleine stroom en deze stroom zorgt in een luidspreker voor een hoorbaar piepje. Hoe meer piepjes je hoort, hoe meer straling er in de buurt is.
 (Afbeelding: ... / Svjo-2; CC BY-SA 2.0)
(Afbeelding: ... / Svjo-2; CC BY-SA 2.0)
Dat radioactieve stoffen overal aanwezig zijn merk je als je een geigerteller bijvoorbeeld midden in een klaslokaal aanzet. Ook in dat geval zal je af en toe een piepje horen. De straling uit alledaagse voorwerpen om ons heen noemen we achtergrondstraling. Dit gaat meestal echter maar om een paar piepjes per minuut. Als je de geigerteller echter dicht bij een sterke radioactieve bron houdt, dan hoor je vaak zoveel piepjes dat het niet meer handmatig te tellen is.
 EXPERIMENT
EXPERIMENT
|
| In deze filmpjes wordt de geigerteller gedemonsteerd. In het eerste filmpje zien we dat een type bord dat vroeger gebruikt werd radioactief materiaal bevat. In het tweede filmpje kan je aan het begin de achtergrondstraling horen. Later in het filmpje wordt de geigerteller bij een radioactieve bron gebracht. |
Maar wat maakt straling eigenlijk gevaarlijk? Als straling met genoeg bewegingsenergie een atoomkern verlaat, dan kan het andere atomen ioniseren. De mate waarin straling in staat is andere atomen te ioniseren noemen we het ioniserend vermogen. Ioniserende straling kan schadelijk zijn voor de gezondheid. Het kan bijvoorbeeld het DNA beschadigen en dit kan het begin zijn van een tumor. Het is dus belangrijk dat we in omgang met radioactieve bronnen goede voorzorgsmaatregelen treffen.
Er zijn twee manieren waarop je schade kan ondervinden van straling. De eerste is bestraling. Bij bestraling bevindt de radioactieve bron zich buiten het lichaam en ondervindt het lichaam schade door de straling die uit deze bron schiet. Als deze stralingsdeeltjes echter hun impact gemaakt hebben, dan zijn ze verder onschadelijk. Als je dus van de bron wegloopt, dan neemt de schade niet toe. De straling zelf is immers niet radioactief. Bij besmetting komt de radioactieve bron in het lichaam terecht. Het is dus niet mogelijk om van deze bron weg te lopen. Besmetting is daarom over het algemeen gevaarlijker dan bestraling.
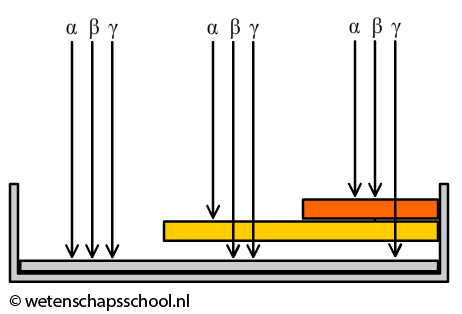
Mensen die werken met radioactieve stoffen dragen vaak een badge. Een badge maakt gebruik van het verschil in doordringend vermogen van de verschillende typen straling. Hoe hoger het doordringend vermogen, hoe gemakkelijker de straling door materialen heendringt. Alfastraling heeft een klein doordringend vermogen. Zelfs door lucht kan alfastraling slechts enkele centimeters voortbewegen. Bètastraling heeft een groter doordringend vermogen en dat van gammastraling is het grootst. In de onderstaande linker afbeelding zien we een doorsnede van de badge. Het linker deel van de badge laat alle soorten straling door. Het middelste deel laat bèta- en gammastraling door en het rechter deel alleen gammastraling. De straling die doorgelaten wordt komt tegen een film aan die verkleurt door straling. Door de verkleuring op de drie plekken te vergelijken, kan je voor elk type straling achterhalen aan hoeveel straling de badge (en dus de persoon) heeft blootgestaan.
 Demonstratievideo
Demonstratievideo
| ||
|
Maar naast de gevaren hebben radioactieve stoffen ook veel voordelen. In de eerste paragraaf hebben we gelezen dat we er bijvoorbeeld energie mee kunnen opwekken. In deze paragraaf gaan we leren dat radioactieve stoffen ook veel in het ziekenhuis gebruikt worden om het lichaam in kaart te brengen en zo te achterhalen wat er aan de hand is met een patiënt.
Een bekende techniek is scintigrafie. Bij deze techniek wordt er een radioactieve stof, genaamd een tracer, in het lichaam gespoten. Deze stof hoopt zich op bepaalde plekken in het lichaam op en zendt hier gammastraling uit. Een deel van deze straling zal het lichaam verlaten. Gammastraling heeft immers een groot doordringend vermogen. Buiten het lichaam kan de gammastraling opgevangen worden door een detector. Hiermee kan een foto van de binnenkant van het lichaam gemaakt worden.
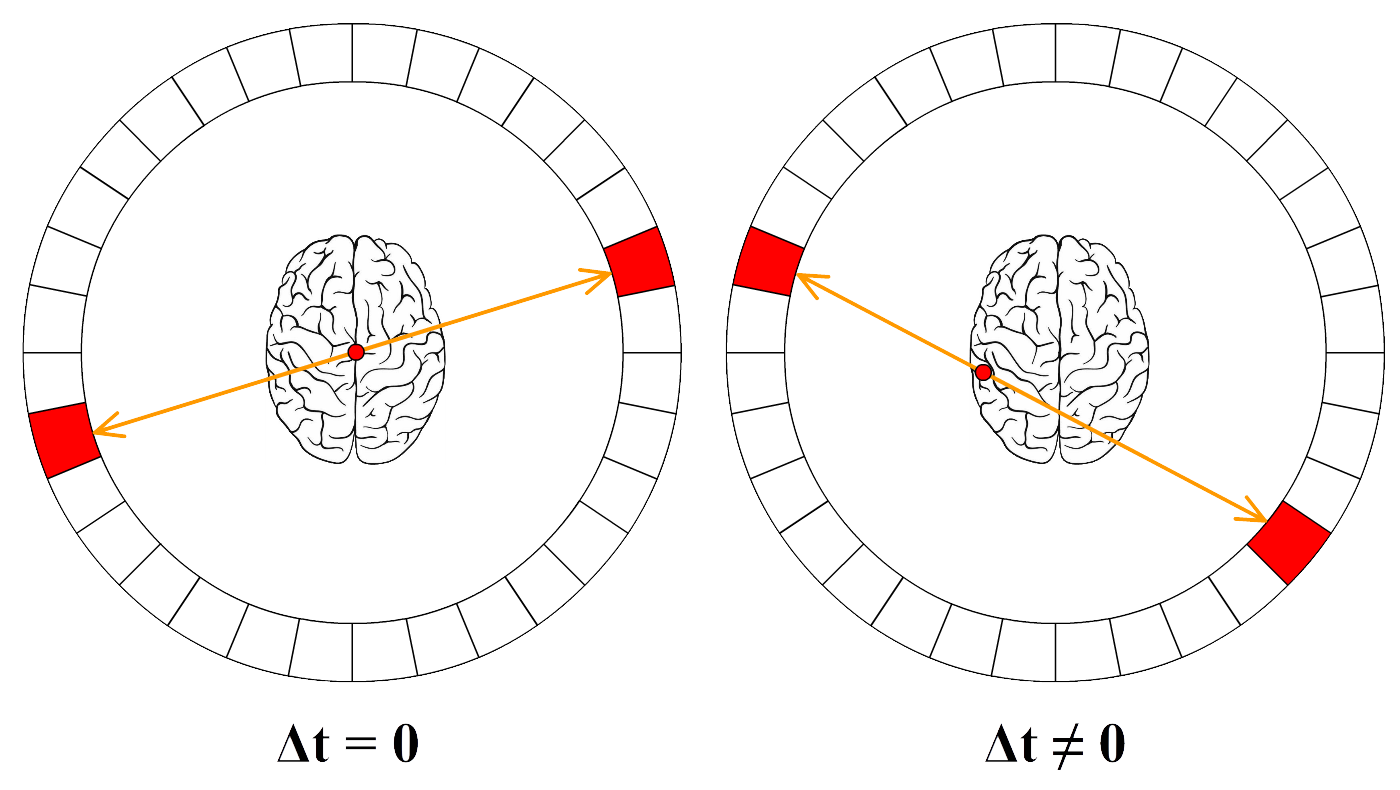
Een bekend voorbeeld hiervan is de PET-scan. Als de radioactieve stof bij een PET-scan vervalt, dan ontstaan twee fotonen die in tegengestelde richting wegschieten. Een deel van deze fotonen zal het lichaam verlaten en wordt gedetecteerd door een cirkelvormige detector, zoals in de volgende afbeelding is weergegeven. Deze detector maakt dan een "foto" met behulp van deze straling.
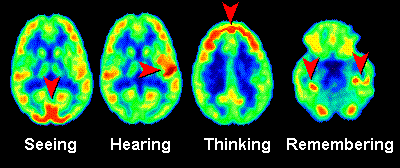
In de onderstaande linker afbeelding zien we PET-scans van de hersenen. Er is in dit geval als tracer radioactief glucose (suiker) gebruikt. Hersendelen die meer actief zijn nemen meer glucose op en als gevolg lichten deze delen meer op in de PET-scan. Op deze manier kunnen we dus een idee krijgen van hersenactiviteit.
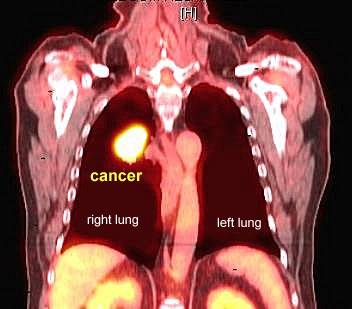
Dezelfde methode kan ook gebruikt worden bij het opsporen van tumoren. Tumoren gebruiken namelijk relatief veel glucose en lichten daarom duidelijk op in de scan. In de rechter afbeelding zien we een tumor die oplicht in de longen.
 (Afbeelding: Phelps & Mazziotta, UCLA)
(Afbeelding: Phelps & Mazziotta, UCLA)
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
| BINAS: | |
| 22 | Doordringend vermogen |
| 32 | Elementen, atoomnummer, massagetal, halfwaardetijd en soort straling |
| 34 | Periodiek systeem |