Hoofdstuk 6
Chemische reacties
§1 Chemische reacties §2 Reactiesnelheid §3 Reactievergelijkingen §4 Verbrandingsreacties §5 Behoud van massa en massaverhouding §6 Overmaat §7 Massaverhouding II (VWO)
§1 Chemische reacties
In dit hoofdstuk gaan we chemische reacties bestuderen. We gaan leren reactievergelijkingen uit te schrijven en gaan uitzoeken in welke massaverhouding stoffen met elkaar reageren. In deze eerste paragraaf gaan we chemische reacties in woorden beschrijven. Ook gaan we het verschil leren tussen endotherme en exotherme reacties.
In sommige situaties kunnen stoffen veranderen in andere stoffen. Als dit gebeurt, spreken we van een chemische reactie. Chemische reacties kunnen we beschrijven met een reactieschema. In een reactieschema schrijven we schematisch op welke stoffen voor de reactie aanwezig waren (de reactanten) en welke stoffen na de reactie zijn ontstaan (de producten):
$$ \mathrm{reactant} 1 + \mathrm{reactant} 2 + \mathrm{...} \rightarrow \mathrm{product} 1 + \mathrm{product} 2 + \mathrm{...} $$Laten we als voorbeeld de verbranding van staalwol nemen. Zoals we eerder gelezen hebben, reageert het ijzer waaruit het staalwol bestaat met de zuurstof in de lucht en ontstaat er ijzeroxide. De reactanten zijn dus ijzer en zuurstof en het product is ijzeroxide. We schrijven dit op als:
$$ \mathrm{ijzer} + \mathrm{zuurstof} \rightarrow \mathrm{ijzeroxide} $$Bij verbrandingsreacties komt ook energie vrij in de vorm van warmte. We noemen reacties waarbij warmte vrij komt exotherme reacties. Ook deze energie kunnen we in het reactieschema noteren. In dit geval vinden we:
$$ \mathrm{ijzer} + \mathrm{zuurstof} \rightarrow \mathrm{ijzeroxide} + \mathrm{\textbf{energie}}$$De energie staat aan de rechter kant van de pijl genoteerd, omdat de energie tijdens de reactie ontstaat.
Er bestaan ook reacties waarbij energie gebruikt wordt. Als gevolg koelt de stof af. De noemen dit endotherme reacties. Een voorbeeld is het oplossen van salmiak in water (zie de onderstaande video). Het bijbehorende reactieschema is:
$$ \mathrm{salmiak} + \mathrm{water} + \mathrm{\textbf{energie}} \rightarrow \mathrm{ammonium} + \mathrm{chloride}$$Zoals je kan zien staat de energie nu aan de linkerkant van de vergelijking genoteerd.
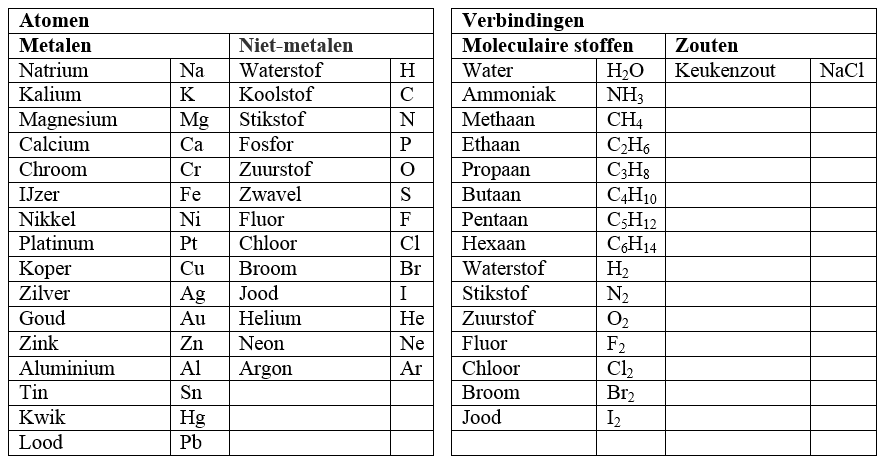
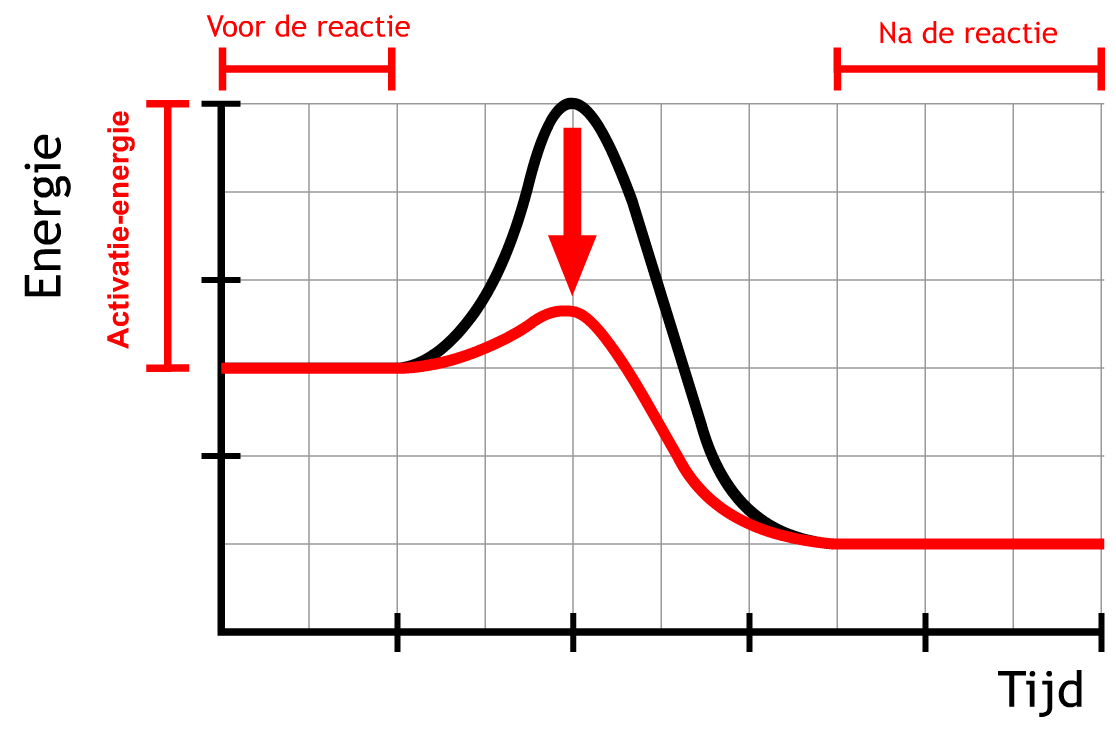
We kunnen endotherme en exotherme reacties beter begrijpen met behulp van de onderstaande diagrammen. Op de verticale as staat in beide diagrammen de chemische energie die in de stoffen zit opgeslagen en op de horizontale as de tijd. In het eerste diagram zien we een exotherme reactie. Zoals je ziet moet de energie voor de reactie eerst toenemen. We noemen dit de activatie-energie. Dit is de energie die nodig is om de reactie te laten plaatsvinden. Een brandstof moeten we bijvoorbeeld eerst aansteken voordat ontbranding plaatsvindt. Na de reactie is de grafiek bij een exotherme reactie lager dan aan het begin. Er is dus chemische energie verloren gegaan uit de stoffen en deze energie is afgestaan aan de omgeving. Als gevolg wordt de omgeving warmer.
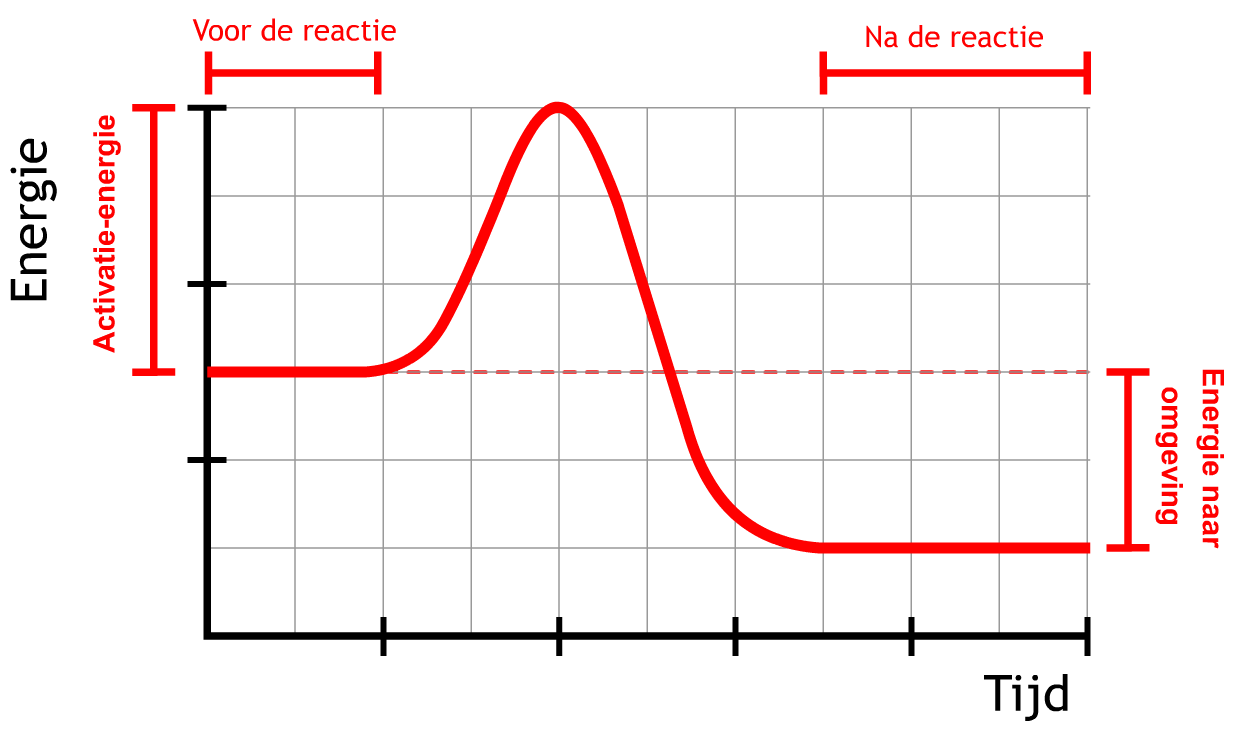
In het tweede diagram zien we de grafiek behorende bij een endotherme reactie. Ook hier is eerst activatie-energie nodig. Na de reactie hebben de stoffen in dit geval echter meer energie dan aan het begin. Deze energie is afkomstig uit de omgeving. Als gevolg wordt de omgeving kouder.
 Zorg dat je reactieschema's kan opstellen inclusief de energie bij endotherme en exotherme reacties
Zorg dat je reactieschema's kan opstellen inclusief de energie bij endotherme en exotherme reacties
|
|
§2 Reactiesnelheid
In deze paragraaf gaan we bestuderen hoe snel reacties verlopen.
In de vorige paragraaf hebben we geleerd een chemische reactie te beschrijven met een reactieschema. In deze paragraaf gaan we bestuderen hoe snel reacties verlopen. De reactiesnelheid tussen twee stoffen hangt o.a. af van:
- De temperatuur
- De verdelingsgraad
- Het aanwezig zijn van een katalysator
Hoe hoger de temperatuur van een stof, hoe sneller de deeltjes waaruit de stof bestaat bewegen. De deeltjes botsen hierdoor vaker en de botsingen zijn ook heftiger. Het resultaat is dat de reactiesnelheid omhoog gaat.
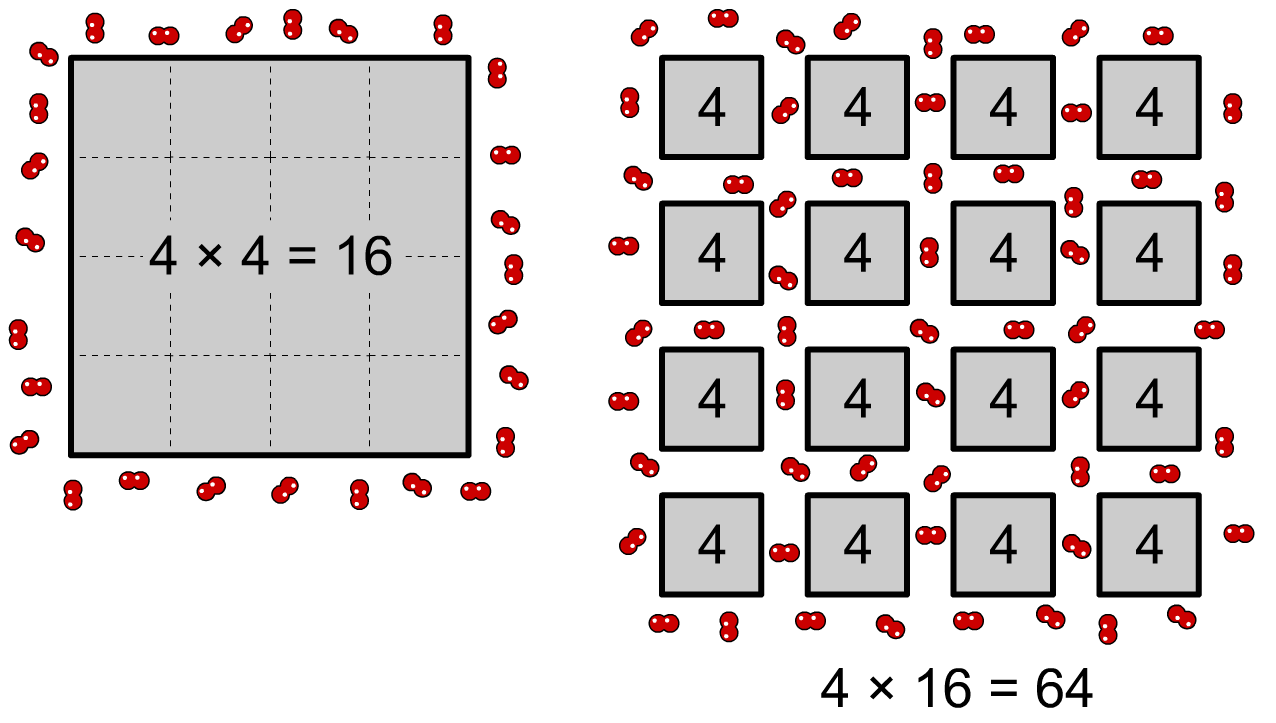
De verdelingsgraad vertelt ons hoe groot het contactoppervlak is tussen twee stoffen die met elkaar reageren. Neem als voorbeeld het verbranden van hout. Een groot blok hout heeft een relatief klein contactoppervlak en als gevolg is de reactiesnelheid niet optimaal. Een even groot volume houtsnippers daarentegen hebben een veel groter contact oppervlak. Dit verklaart waarom het gemakkelijker is om houtsnippers in brand te steken. In de onderstaande afbeelding wordt dit effect duidelijk. In de linker afbeelding komt zuurstof in aanraking met een blok met 16 centimeter aan omtrek. In de rechter afbeelding is het blok verdeeld in 16 stukken en komt zuurstof in aanraking met 64 centimeter aan omtrek. Dit is 4 keer zo veel!
Een katalysator is een stof die een reactie versnelt. Als voorbeeld bestuderen we de ontleding van waterstofperoxide in water en zuurstof:
$$ \mathrm{waterstofperoxide} \rightarrow \mathrm{water} + \mathrm{zuurstof} + \mathrm{\textbf{energie}}$$Deze reactie verloopt normaal gesproken extreem langzaam, maar als we de katalysator kaliumjodide toevoegen, dan verloopt de reactie veel sneller (zie het onderstaande filmpje):
Een eigenschap van katalysatoren is dat ze wel gebruikt worden tijdens een reactie, maar niet verbruikt. Na de reactie is er dus nog evenveel katalysator over als daarvoor en dit betekent dat we de katalysator dus kunnen hergebruiken.
In het menselijk lichaam bevinden zich ook katalysatoren die processen als de spijsvertering versnellen. Deze katalysatoren zorgen ervoor dat allerlei reacties plaats kunnen vinden die normaal alleen bij hoge temperaturen kunnen plaatsvinden. De katalysatoren in ons lichaam worden enzymen genoemd. Enzymen zijn grote moleculen met een speciale vorm waar andere moleculen precies in kunnen klikken (zie de onderstaande afbeelding). Nadat dit gebeurd is, kan het enzym het ingevangen molecuul bijvoorbeeld opdelen in twee kleinere moleculen.
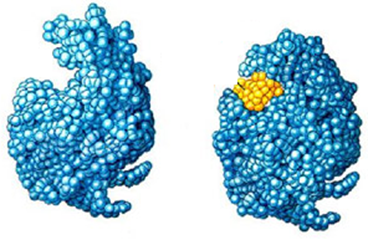 (Afbeelding: Biocyclopedia)
(Afbeelding: Biocyclopedia)
Het effect van een katalysator is ook in een energiediagram goed te zien. Het verlaagt de activatie-energie die nodig is om een reactie op gang te brengen.
Een extreem snelle reactie waarbij extreem veel energie vrijkomt noemen we een explosie. Voorbeelden zijn de gecontroleerde explosies van benzine in de motor van een auto. Een ander voorbeeld van een explosie is het exploderen van dynamiet (zie de volgende afbeelding).
 (Afbeelding: National Nuclear Security Administration; PD)
(Afbeelding: National Nuclear Security Administration; PD)
 Zorg dat je kan redeneren met de drie factoren die invloed hebben op de reactiesnelheid
Zorg dat je kan redeneren met de drie factoren die invloed hebben op de reactiesnelheid
|
|
§3 Reactievergelijkingen
In deze paragraaf gaan we met onze kennis van atomen en moleculen reactievergelijkingen uitschrijven.
In de 19de eeuw vond de wetenschapper John Dalton aanwijzingen voor het bestaan van atomen en moleculen. Hieronder zien we een schets die Dalton hiervan maakte.
Dalton begreep dat tijdens chemische reacties de moleculen veranderen, maar de atomen niet. Hieronder zien we bijvoorbeeld een reactie tussen een methaanmolecuul (CH4) en twee zuurstofmoleculen (2O2). Bij deze reactie ontstaat een koolstofdioxidemolecuul (CO2) en twee watermoleculen (2H2O). Merk op dat alle atomen die voor de reactie aanwezig waren, ook na de reactie aanwezig zijn. Aan beide kanten van de vergelijking zien we 4 waterstofatomen, 4 zuurstofatomen en 1 koolstofatoom. Het enige dat dus gebeurt is, is dat de atomen zich hebben herverdeeld en zo dus andere moleculen vormen.
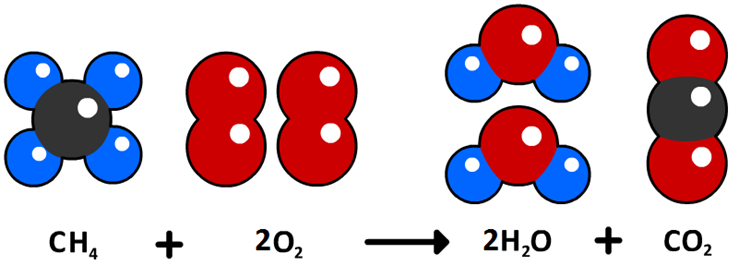
In de eerste paragraaf hebben we reactieschema's besproken. Hier werden de stoffen in woorden opgeschreven. In de bovenstaande afbeelding zien we niet de namen van de stoffen, maar de molecuulformules. In dat geval spreken we van een reactievergelijking.
Om reactievergelijkingen goed te begrijpen is het handig reacties na te bouwen met bijvoorbeeld legoblokjes (zie de onderstaande afbeelding). Tijdens chemische reacties veranderen de bouwsels (de moleculen), maar de legoblokjes zelf (de atomen) blijven onveranderd.
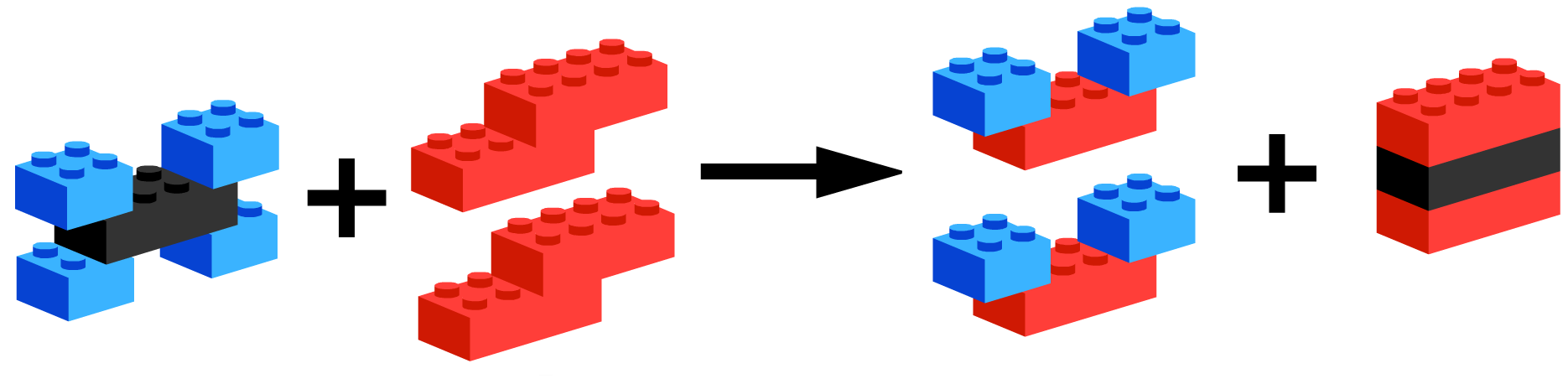
Laten we nog een voorbeeld bestuderen. Als we elektriciteit door water (H2O) laten stromen, dan ontleedt het in zuurstofgas (O2) en waterstofgas (H2). In eerste instantie zal je misschien denken dat de reactievergelijking er als volgt uit ziet:
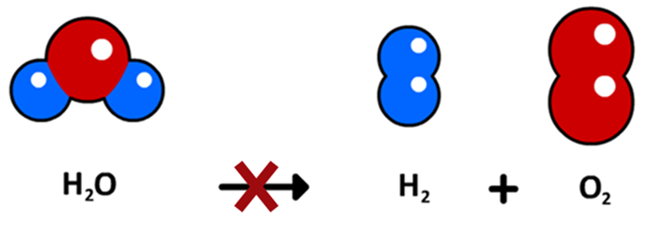
Deze reactievergelijking klopt echter niet, want het aantal atomen voor en na de reactie is niet gelijk. We kunnen dit probleem oplossen door coëfficiënten toe te voegen. Dit zijn de getallen die we voor molecuulformules schrijven om het aantal moleculen aan te geven. Hieronder is dit gedaan:
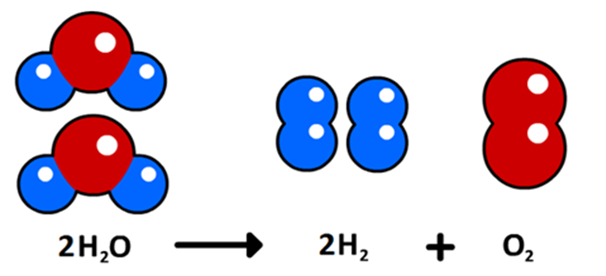
De reactievergelijking is nu kloppend gemaakt. Zoals je ziet hebben we aan zowel de linker- als de rechterzijde twee zuurstofatomen en vier waterstofatomen.
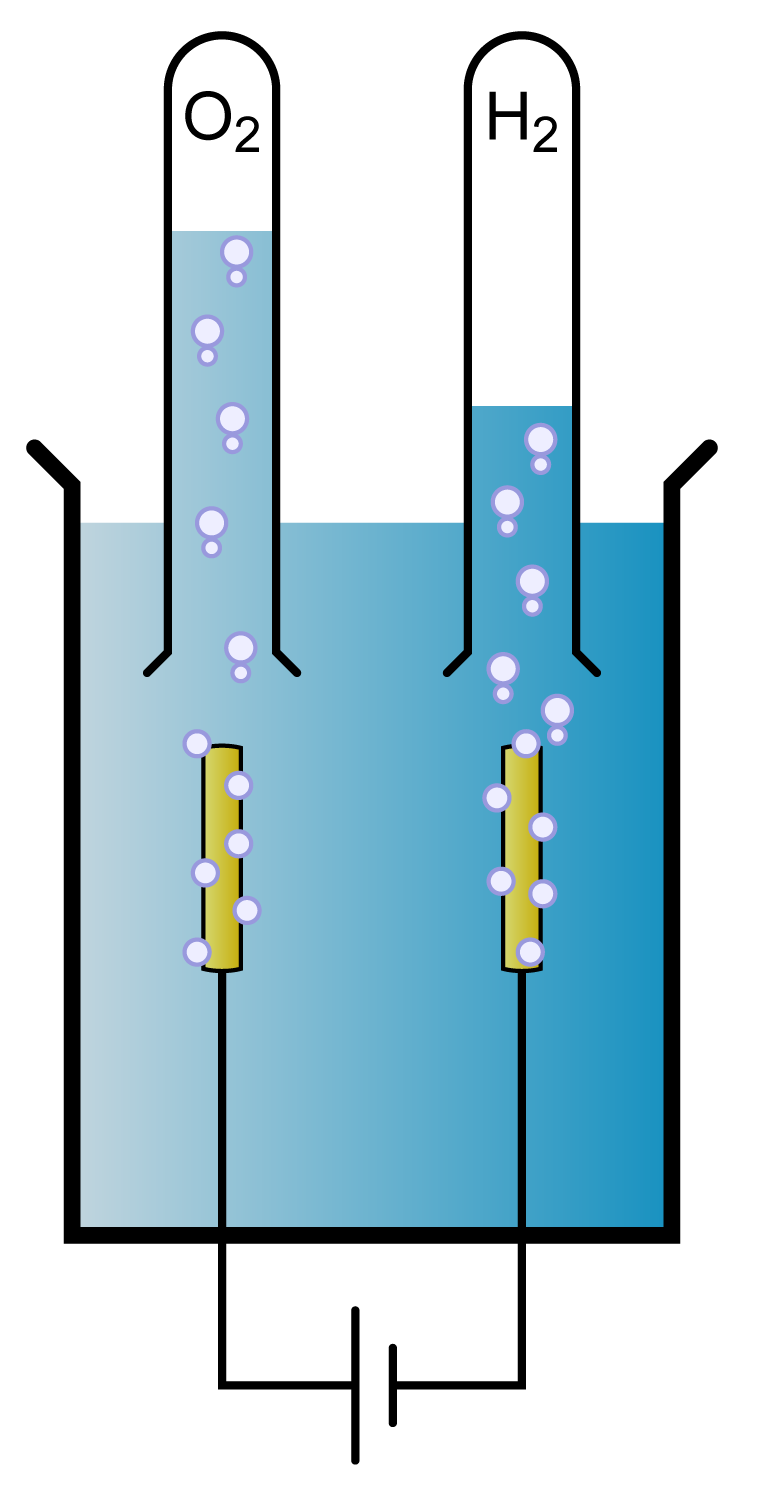
Merk ook op dat er bij deze reactie twee keer zoveel waterstof als zuurstof is ontstaan. Dit kunnen we experimenteel nagaan. Als we elektriciteit door water laten lopen, dan ontstaat er inderdaad twee keer zoveel waterstof als zuurstof. Dit kun je zien in de onderste afbeelding, waar in de linker buis zuurstof is ontstaan en in de rechter buis waterstof (dat het linker gas waterstof is kunnen we aantonen door er een lucifer bij te houden. Waterstof is immers brandbaar).
Laten we nog een voorbeeld uitwerken. Als ammoniak (NH3) reageert met zuurstof, dan ontstaat stikstofdioxide. Een eerste poging tot een reactievergelijking is:
$$ \text{NH}_3 + \text{O}_2 \rightarrow \text{NO}_2 + \text{H}_2\text{O} $$Het is handig om bij het kloppend maken niet te beginnen met de atomen die aan dezelfde kant van de vergelijking meerdere keren voorkomen. In dit voorbeeld is dit het geval voor zuurstof. Zuurstof gaan we pas als laatst kloppend maken. Laten we beginnen met de waterstofatomen:
$$ 2\text{NH}_3 + \text{O}_2 \rightarrow \text{NO}_2 + 3\text{H}_2\text{O} $$Nu hebben we aan beide kanten 6 waterstofatomen. Nu dan de stikstof:
$$ 2\text{NH}_3 + \text{O}_2 \rightarrow 2\text{NO}_2 + 3\text{H}_2\text{O} $$We hebben nu aan beide kanten 2 stikstofatomen. Dan de zuurstof. Aan de rechterkant hebben we in totaal 7 zuurstofatomen. Als we dit links ook willen hebben zouden we 3,5 O2 moleculen nodig hebben:
$$ 2\text{NH}_3 + 3,5\text{O}_2 \rightarrow 2\text{NO}_2 + 3\text{H}_2\text{O} $$3,5 O2 is natuurlijk onzinnig. We lossen dit op door alle stoffen in de reactie te verdubbelen:
$$ 4\text{NH}_3 + 7\text{O}_2 \rightarrow 4\text{NO}_2 + 6\text{H}_2\text{O} $$Nu is de reactie kloppend.
 Zorg dat je reactievergelijkingen kloppend kan maken
Zorg dat je reactievergelijkingen kloppend kan maken
|
|
§4 Verbrandingsreacties
In deze paragraaf gaan we nauwkeuriger kijken naar verbrandingsreacties. We gaan deze reacties opschrijven met reactievergelijkingen.
In deze paragraaf gaan we verschillende verbrandingsreacties kloppend maken. Neem bijvoorbeeld de verbranding van aardgas. Aardgas bestaat uit het brandbare gas methaan (CH4). Als methaan verbrandt in de aanwezigheid van voldoende zuurstof, dan ontstaan de stoffen water en koolstofdioxide. We noemen dit de volledige verbranding van aardgas. Onze eerste poging voor het maken van de reactievergelijking wordt hiermee:
$$ \mathrm{CH}_4 + \mathrm{O}_2 \rightarrow \mathrm{CO}_2 + \mathrm{H}_2\mathrm{O} $$Nu maken we de reactie kloppend (zoals we in de vorige paragraaf geleerd hebben):
$$ \mathrm{CH}_4 + 2\mathrm{O}_2 \rightarrow \mathrm{CO}_2 + 2\mathrm{H}_2\mathrm{O} $$Ga zelf na dat we alle atomen van voor de reactie ook na de reactie vinden.
(VWO) We sluiten deze paragraaf af met de verbranding van natrium. Bij deze reactie ontstaat natriumoxide. In woorden is de reactievergelijking:
$$ \mathrm{natrium} + \mathrm{zuurstof} \rightarrow \mathrm{natriumoxide} $$Natriumoxide is een zout en een zout bestaat uit ionen. In het periodiek systeem vinden we dat een natriumion een lading van 1+ heeft en een oxide-ion een lading van 2-. De verhoudingsformule wordt hiermee Na2O.
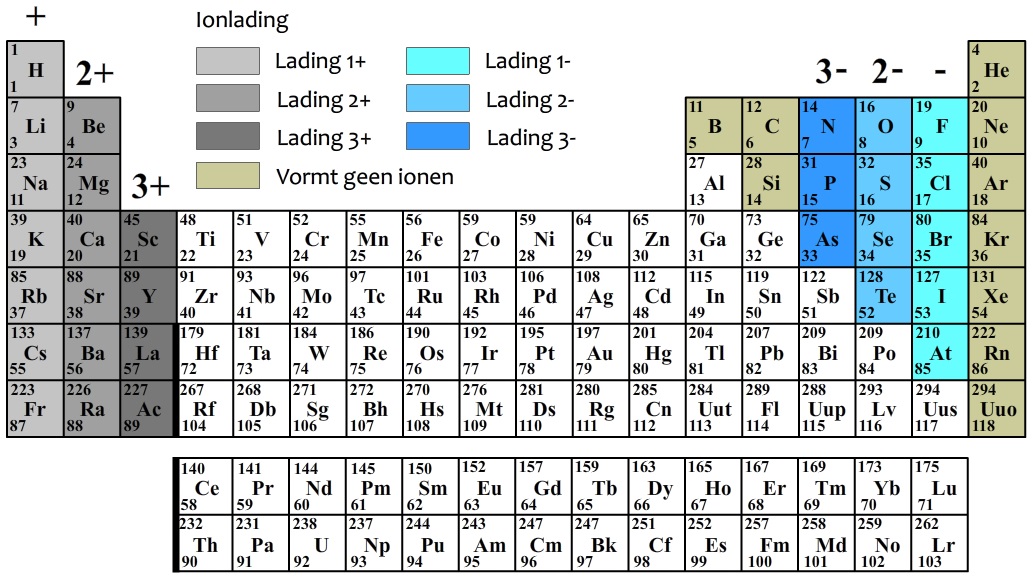
De eerste poging tot een reactievergelijking wordt dus:
$$ \mathrm{Na} + \mathrm{O}_2 \rightarrow \mathrm{Na_2O} $$Merk op dat we het metaal natrium gewoon als "Na" hebben genoteerd. Dit kunnen we doen omdat metalen geen moleculen vormen. Voor zuurstof gebruiken we O2, omdat een zuurstofmolecuul altijd uit twee zuurstofatomen bestaat.
Nu maken we de reactievergelijking kloppend:
$$ 4\mathrm{Na} + \mathrm{O}_2 \rightarrow 2\mathrm{Na_2O} $$Ga zelf na dat de reactie klopt.
 Zorg dat je reactievergelijkingen van verbrandingsreacties kloppend kan maken
Zorg dat je reactievergelijkingen van verbrandingsreacties kloppend kan maken
|
|
§5 Behoud van massa en massaverhouding
In deze paragraaf introduceren we eerst een belangrijk principe uit de scheikunde genaamd het behoud van massa. We gaan dit principe daarna gebruiken om uit te rekenen in welke massaverhouding verschillende stoffen reageren.
Omdat we voor en na de reactie nog precies dezelfde atomen hebben, volgt ook automatisch dat de massa voor en na de reactie gelijk moet zijn. We noemen dit principe de wet van behoud van massa.
Bij sommige reacties lijkt het in eerst instantie of massabehoud niet geldt. Neem bijvoorbeeld het verbranden van een blok hout. Als je het blok voor en na de reactie weegt, dan zie je dat er massa verdwenen is. Dit komt echter doordat er bij de verbranding gassen zijn vrijgekomen. Als deze gassen netjes opgevangen worden en gewogen worden, dan blijkt dat de massa netjes gelijk gebleven is.
Nog een voorbeeld. Als een stuk ijzer oxideert, dan wordt het juist zwaarder. Ook hier lijkt massabehoud in eerst instantie niet te gelden, maar bij nadere inspectie blijkt dat het ijzer zuurstof heeft opgenomen uit de lucht. Als deze zuurstof ook gewogen wordt, dan blijkt massabehoud wederom te gelden.
Laten we dit principe gebruiken in een rekensommetje. We bestuderen hiervoor het ontleden van waterstofchloride (HCl) in waterstofgas (H2) en chloorgas (Cl2).
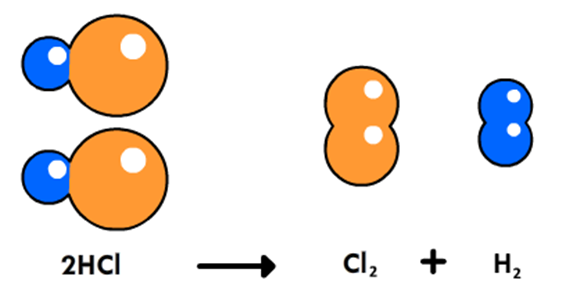
In de reactievergelijking zien we dat er evenveel waterstofgas als chloorgas ontstaat. Het volume van beide gassen is dus gelijk, maar dit geldt niet voor de massa. In het periodiek systeem zien we dat een waterstofatoom een massagetal van 1 heeft, terwijl een chlooratoom een massagetal van 35 heeft. Dit betekent dat het chloorgas 35&tims; zo zwaar is als het waterstofgas. We zeggen in zo'n geval dat de massaverhouding tussen het waterstofgas en het chloorgas 1 : 35 is.
Stel dat we bijvoorbeeld 2,25 gram waterstofgas willen maken. Hoeveel gram chloorgas komt hier dan bij vrij? Dit kunnen we nu uitrekenen met een simpele verhoudingstabel.
| Waterstof | 1 gram | 2,25 gram |
| Chloor | 35 gram | 78,75 gram |
Als we 2,25 gram waterstofgas maken met deze reactie, dan ontstaat er dus ook 78,75 gram chloorgas.
Nog een voorbeeld. Stel we ontleden 70 gram waterstofchloride. Hoeveel gram waterstof en hoeveel gram chloor komt hier dan bij vrij?
We weten dat als er 1 gram waterstof ontstaat, dat er dan 35 gram chloor ontstaat. Volgens de wet van behoud van massa moet de waterstofchloride waaruit dit is ontstaan, een massa hebben van 1 + 35 = 36 gram. We kunnen op basis hiervan de volgende verhoudingstabel maken, waarmee we uitrekenen hoeveel gram waterstofgas en hoeveel gram chloorgas er vrijkomt bij de ontleding van 70 gram waterstofchloride:
| Waterstof | 1 gram | 1,94 gram |
| Chloor | 35 gram | 68,06 gram |
| Waterstofchloride | 36 gram | 70 gram |
We kunnen nog even checken of we dit goed hebben uitgerekend, door de 1,94 gram waterstofgas en de 68,06 gram chloorgas bij elkaar op te tellen. We vinden dan inderdaad 1,94 + 68,06 = 70 gram. Dit klopt precies.
Laten we nog een reactie bestuderen.
$$ 2\text{Mg} + \text{O}_2 \rightarrow 2\text{MgO} $$In het periodiek systeem lezen we dat het massagetal van zuurstof 16 is en dat het massagetal van magnesium 24 is. De massaverhouding tussen zuurstof en magnesium is dus 16 : 24. We kunnen deze verhouding versimpelen tot 2 : 3 door beide kanten door 8 te delen. Dit betekent dus dat 2 gram zuurstof volledig reageert met 3 gram magnesium.
Stel dat we 16,5 gram magnesium willen laten reageren met zuurstof. Hoeveel gram zuurstof hebben we hier dan voor nodig? Ook dit berekenen we met een verhoudingstabel:
| Zuurstof | 2 gram | 11 gram |
| Magnesium | 3 gram | 16,5 gram |
Hoeveel gram magnesiumoxide is er dan ontstaan? Dit kunnen we vinden met behulp van de wet van behoud van massa. Als 16,5 gram magnesium en 11 gram zuurstof met elkaar reageren, dan ontstaat er 16,5 + 11 = 27,5 gram magnesiumoxide.
Open het periodiek systeem in een nieuwe tab.
 Redeneren met massabehoud
Redeneren met massabehoud
|
|
 Rekenen met massaverhoudingen
Rekenen met massaverhoudingen
|
|
§6 Overmaat
In sommige situaties is er bij een reactie te veel van één van de stoffen aanwezig, waardoor niet alles kan reageren. We spreken dan van een overmaat. In deze paragraaf gaan we hier mee rekenen.
Stel we laten 25 gram magnesium en 25 gram zuurstof met elkaar reageren. Hoeveel gram magnesiumoxide ontstaat er dan? In de vorige paragraaf hebben we gezien dat zuurstof en magnesium reageren met massaverhouding 2 : 3. Eerst rekenen we uit hoeveel magnesium we kunnen laten reageren met 25 gram zuurstof.
| Zuurstof | 2 gram | 25 gram |
| Magnesium | 3 gram | 37,5 gram |
Als we 25 gram zuurstof willen laten reageren, dan hebben we dus wel 37,5 gram magnesium nodig. Maar we hebben slechts 25 gram magnesium, dus deze informatie is niet echt bruikbaar. Laten we in plaats daarvan eens uitrekenen hoeveel zuurstof er nodig is om 25 gram magnesium te laten reageren:
| Zuurstof | 2 gram | 16,7 gram |
| Magnesium | 3 gram | 25 gram |
Er is dus slechts 16,7 gram zuurstof nodig om 25 gram magnesium te laten reageren. Maar we begonnen met 25 gram zuurstof. Dit betekent dat als alle magnesium gereageerd heeft, er nog steeds 25 - 16,7 = 8,3 gram zuurstof over is. We zeggen dan dat de zuurstof in overmaat aanwezig is.
Met behulp van de wet van behoud van massa kunnen we ook uitrekenen dat er 25 + 16,7 = 41,7 gram magnesiumoxide is ontstaan. We vatten de reactie als volgt samen:
$$ \textbf{25 } \mathrm{g\;magnesium} + \textbf{25 } \mathrm{g\;zuurstof} \rightarrow \textbf{41,7 } \mathrm{g\;magnesiumoxide} + \textbf{8,3 } \mathrm{g\;zuurstof} $$Merk op dat de massa van de stoffen aan beide kanten van de vergelijking in totaal 50 gram is. Dit is in overeenstemming met de wet van behoud van massa.
 Rekenen met overmaat
Rekenen met overmaat
|
|
§7 Massaverhouding II (VWO)
In deze paragraaf gaan we de kennis uit het hoofdstuk zouten combineren met de kennis over massaverhoudingen. We doen dit aan de hand van een voorbeeld.
Vraag: Als magnesium (Mg) met fosfor (P4) reageert, ontstaat het zout magnesiumfosfide. Vind de reactievergelijking en bepaal daarna de massaverhouding waarin magnesium en fosfor met elkaar reageren.
Antwoord: Eerst willen we de verhoudingsformule van het zout (magnesiumfosfide) te weten komen. Een zout bestaat niet uit atomen, maar uit ionen. We beginnen met het opschrijven van de ionen waaruit dit zout bestaat:
$$ \mathrm{Mg}^{2+} \;\;\;\; \mathrm{P}^{3-} $$Omdat een zout neutraal is, komen de ionen in de volgende verhouding voor:
$$ \mathrm{Mg}^{2+} \;\; \mathrm{Mg}^{2+} \;\; \mathrm{Mg}^{2+} \;\;\;\; \mathrm{P}^{3-} \;\; \mathrm{P}^{3-}$$De verhoudingsformule wordt dus:
$$ \mathrm{Mg}_3\mathrm{P}_2 $$De eerste poging tot het maken van een reactievergelijking wordt hiermee:
$$ \mathrm{Mg} + \mathrm{P}_4 \rightarrow \mathrm{Mg}_3\mathrm{P}_2 $$De volgende stap is om de reactievergelijking kloppend te maken:
$$ 6\mathrm{Mg} + \mathrm{P}_4 \rightarrow 2\mathrm{Mg}_3\mathrm{P}_2 $$In het periodiek systeem vinden we dat magnesium een massagetal van 24 heeft en fosfor van 31. Er reageren 6 magnesiumatomen. Het totale massagetal hiervan is dus 24 × 6 = 144. Er reageren 4 fosforatomen. Het totale massagetal hiervan is 31 × 4 = 124. De massaverhouding tussen magnesium en fosfor is dus 144 : 124 Deze verhouding kunnen we vereenvoudigen door beide kanten door vier te delen:
36 : 31
We hebben dus gevonden dat magnesium en fosfor in de massaverhouding 36 : 31 reageren bij de vorming van magnesiumfosfide.
Open het periodiek systeem in een nieuwe tab.
 Achterhalen van de massaverhouding aan de hand van de reactievergelijking
Achterhalen van de massaverhouding aan de hand van de reactievergelijking
|
|