Hoofdstuk 2
Mengsels
§1 Mengsels §2 Concentratie §3 Volume- en massaprocent §4 Oplosbaarheid en oplossnelheid
§1 Mengsels
In dit hoofdstuk gaan we verschillende mengsels bestuderen. In deze eerste paragraaf gaan we het hebben over oplossingen en suspensies.
Een stof waar we doorheen kunnen kijken noemen we helder. Als we een stof met een vloeistof mengen en het mengsel blijft helder, dan spreken we van een oplossing. Een voorbeeld van een oplossing is zeewater. In zeewater zit zout opgelost, maar toch kunnen we het zout niet zien. Een ander voorbeeld is het oplossen van suiker in thee. Ook hier lijkt het suiker te "verdwijnen" in het water. Oplossingen kunnen wel een kleur hebben. Denk bijvoorbeeld aan limonade. Limonade is helder, maar heeft vaak wel een kleur.
Hoe komt het dat oplossingen helder zijn? Neem bijvoorbeeld zeewater. Zeewater is helder omdat de zoutdeeltjes zich volledig verspreiden in het water (zie de onderstaande afbeelding). We noemen een dergelijk mengsel een homogeen mengsel. Een zoutdeeltje is een miljoen keer kleiner dan een millimeter en kan dus niet met onze ogen gezien worden. Omdat alle deeltjes los van elkaar door het water bewegen, kunnen we ze dus niet zien.
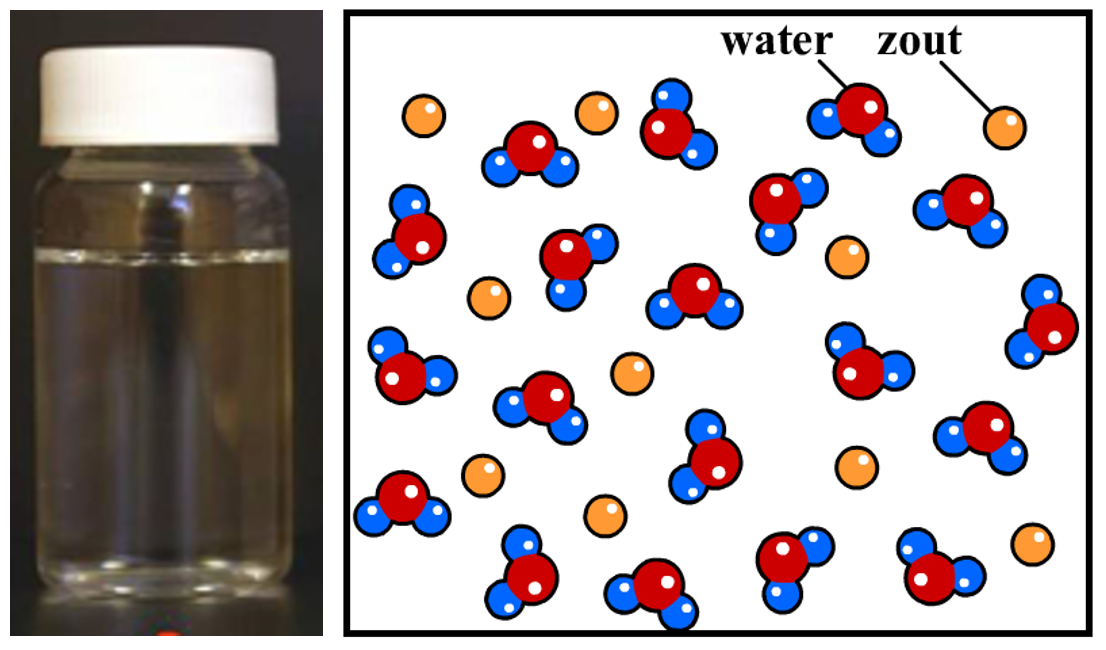
Ook gassen vormen homogene mengsels. Neem bijvoorbeeld de lucht. De lucht bestaat o.a. uit de gassen stikstof, zuurstof en koolstofdioxide. Omdat de deeltjes in een gas los van elkaar bewegen, kunnen gassen altijd goed mengen en vormen ze dus altijd homogene mengsels. Elk mengsel van gassen is helder (maar net als bij vloeistoffen kunnen deze gassen wel een kleur hebben).
Een vloeistof waar we niet doorheen kunnen kijken noemen we troebel. Als we een stof met een vloeistof mengen en het mengsel wordt troebel, dan spreken we van een suspensie. Er ontstaat bijvoorbeeld een suspensie als we krijtstof mengen met water. Een suspensie ontstaat doordat het krijt zich niet perfect mengt met het water. De krijtdeeltjes blijven in kleine klontjes aan elkaar plakken en deze klontjes zweven rond in het water (zie de onderstaande afbeelding). Omdat deze klontjes groot genoeg zijn om met onze ogen te kunnen zien, kunnen we niet door een suspensie heen kijken. We noemen een dergelijk mengsel een heterogeen mengsel.
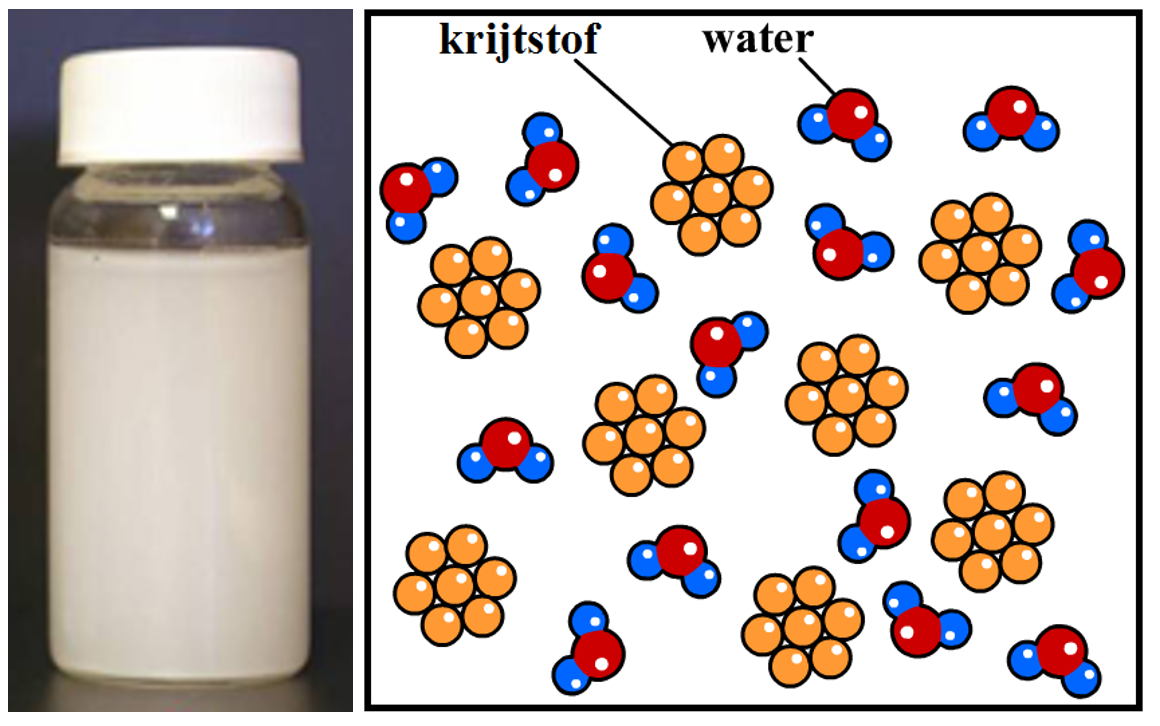
Naast suspensies bestaan er ook nog andere heterogene mengsels. Een voorbeeld is rook. Rook is een collectie van kleine stukjes vaste stof die in de lucht zweven. Rook is dus geen gas, maar bestaat uit kleine stukjes vaste stof (zie de twee onderstaande afbeeldingen).

 (Afbeelding: US Coast Guard; PD / Reinald Kirchner CC BY-SA 2.0)
(Afbeelding: US Coast Guard; PD / Reinald Kirchner CC BY-SA 2.0)
Een ander voorbeeld is een nevel. Nevel is een collectie van kleine vloeibare druppeltjes die in de lucht zweven. We kunnen bijvoorbeeld een nevel maken door een fles haarlak of deodorant te spuiten. Ook wolken en mist zijn nevels. Een nevel is dus geen gas, maar bestaat uit kleine waterdruppeltjes.


 (Afbeelding: Pixabay; PD / Keith Miller; PD / Pixabay; PD)
(Afbeelding: Pixabay; PD / Keith Miller; PD / Pixabay; PD)
Een ander voorbeeld van een heterogeen mengsel is schuim. Een schuim bestaat uit gasbelletjes die zich in een vloeistof of een vaste stof bevinden. Denk bijvoorbeeld aan de "prik" in cola. Dit bestaat uit kleine belletjes koolstofdioxide. Een ander voorbeeld is piepschuim. Dit bestaat uit plastic bolletjes gevuld met lucht.

 (Afbeelding: Pixabay; PD)
(Afbeelding: Pixabay; PD)
Het laatste voorbeeld van een heterogeen mengsel noemen we een emulsie. Een emulsie bestaat uit stoffen die onder normale omstandigheden niet mengen, maar die door een extra stof, genaamd de emulgator, toch mengen. Voorbeelden van emulsies zijn mayonaise, boter en crèmes. Mayonaise bestaat voornamelijk uit olie en een beetje azijn. Zoals je in de linker onderstaande afbeelding kan zien, mengen deze vloeistoffen normale omstandigheden niet. Als emulgator voegen we eigeel toe en zo ontstaat de emulsie mayonaise.
 (Afbeelding: Victor Blacus; CC BY-SA 4.0 / Takeaway; CC BY-SA 3.0)
(Afbeelding: Victor Blacus; CC BY-SA 4.0 / Takeaway; CC BY-SA 3.0)
Hieronder zien we in de tabel samengevat welke homogene en heterogene mengsels we in de tekst besproken hebben.
| Homogeen mengsel | Heterogeen mengsel |
| Oplossing | Suspensie |
| Gasmengsel | Rook |
| Nevel | |
| Schuim | |
| Emulsie |
 Zorg dat je de verschillende soorten homogene en heterogene mengsels kan herkennen en beschrijven
Zorg dat je de verschillende soorten homogene en heterogene mengsels kan herkennen en beschrijven
| ||||||||||||||||
|
§2 Concentratie
In deze paragraaf gaan we leren rekenen met het begrip concentratie. Een bekend voorbeeld waarbij concentratie een rol speelt is limonade. Hoe meer siroop er in een bepaalde hoeveelheid water wordt gedaan, hoe hoger de concentratie.
Als we willen rekenen met concentratie, dan is het noodzakelijk dat we herhalen hoe we rekenen met het volume. Het volume van een stof geeft aan hoeveel ruimte deze stof inneemt. De bekendste eenheden van volume staan hieronder beschreven:
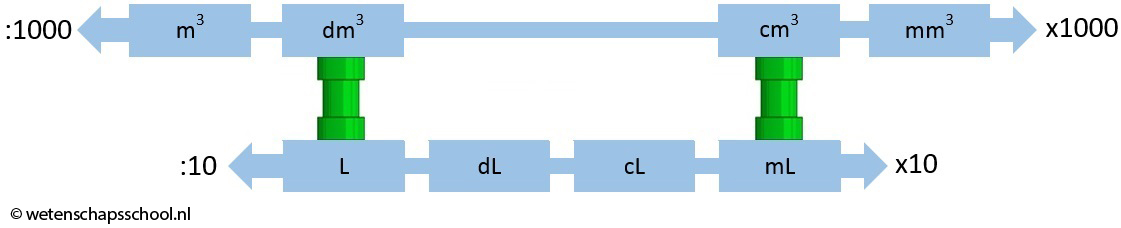
In de vorige afbeelding zien we dat het volume zowel in kubieke meter als in liter weergegeven kan worden. 1 L is bijvoorbeeld exact hetzelfde als 1 dm3. Er geldt dus:
| $$ 1 \text{ L} = 1 \text{ dm}^3$$ |
Om te rekenen met concentratie is het ook van belang dat we kunnen meten hoe "zwaar" stoffen zijn. Hiervoor wordt het begrip massa gebruikt. De massa meten we meestal in:

Normaal gesproken gebruiken we echter alleen de milligram, de gram en de kilogram:

Dan nu de concentratie. Als we twee stoffen met elkaar mengen, dan kunnen we dit in verschillende verhoudingen doen. Denk bijvoorbeeld aan limonade. We kunnen zelf kiezen hoeveel siroop en hoeveel water we toevoegen bij het maken van limonade. De hoeveelheid water en de hoeveelheid siroop bepalen samen hoe zoet de limonade zal worden. Als de limonade erg zoet is, dan spreken we van een hoge concentratie siroop. Als je de siroop bijna niet proeft, dan spreken we van een lage concentratie siroop.
In de onderstaande afbeelding zien we een maatkolf. Stel we schenken 24 gram siroop in de maatkolf en vullen dit daarna aan met water tot aan de stippellijn. Zoals aangegeven op de maatkolf, hebben we dan 1000 mL (oftewel, 1,000 L) limonade. De limonade die we nu gemaakt hebben, heeft een siroopconcentratie van 24 gram per liter (24 g/L).
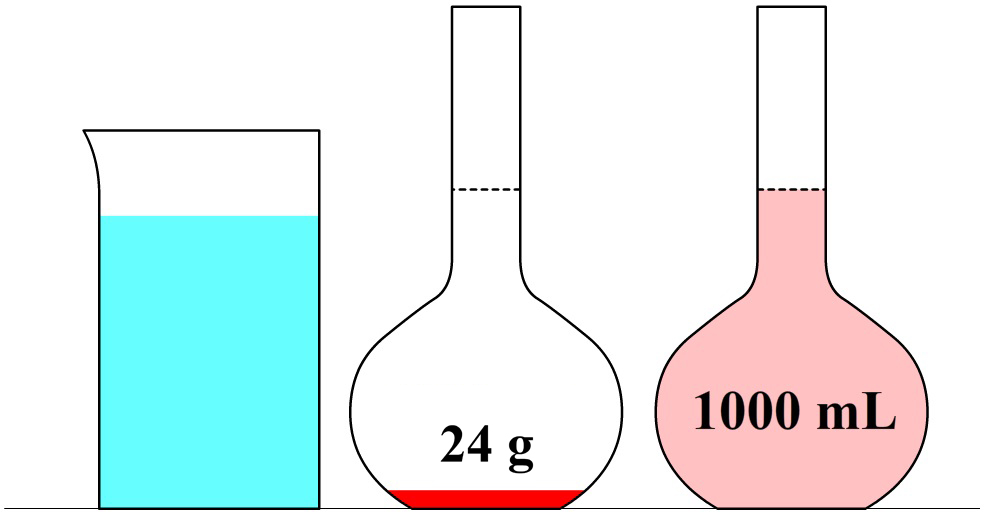
In de volgende maatkolf schenken we 24 gram siroop in een maatkolf en vullen dit aan tot we 2,000 liter limonade hebben. Elke liter limonade bevat in dit geval dus 24 / 2 = 12 gram siroop. De siroopconcentratie is in dit geval dus 12 g/L. In dit tweede voorbeeld is de siroopconcentratie dus lager en als gevolg smaakt de limonade minder zoet.
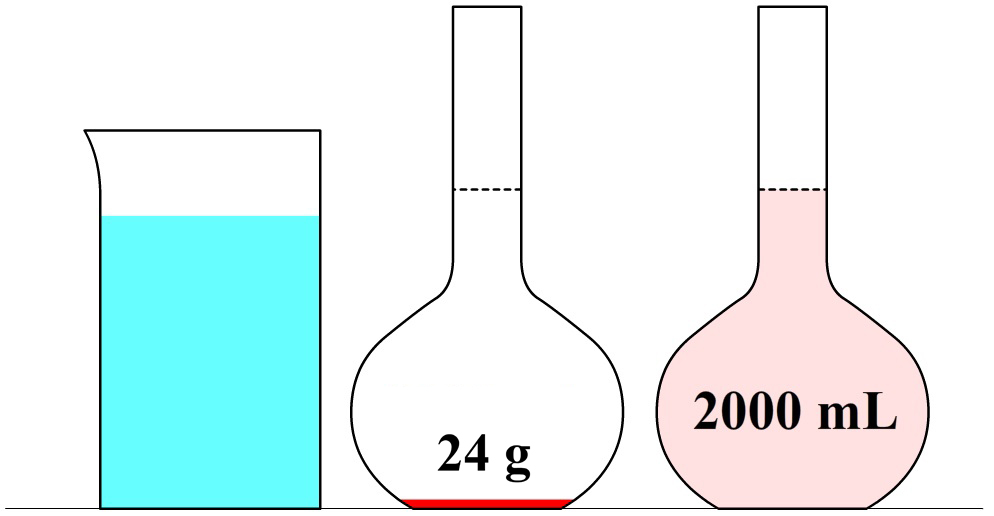
In de volgende maatkolf schenken we 24 gram siroop in een maatkolf en vullen dit aan tot we 0,25 liter limonade hebben. In dit geval zou een liter van deze limonade 24 × 4 = 96 gram siroop bevatten. Deze limonade heeft dus een siroopconcentratie van 96 g/L. In dit voorbeeld is de concentratie dus hoger en smaakt de limonade dus zoeter.
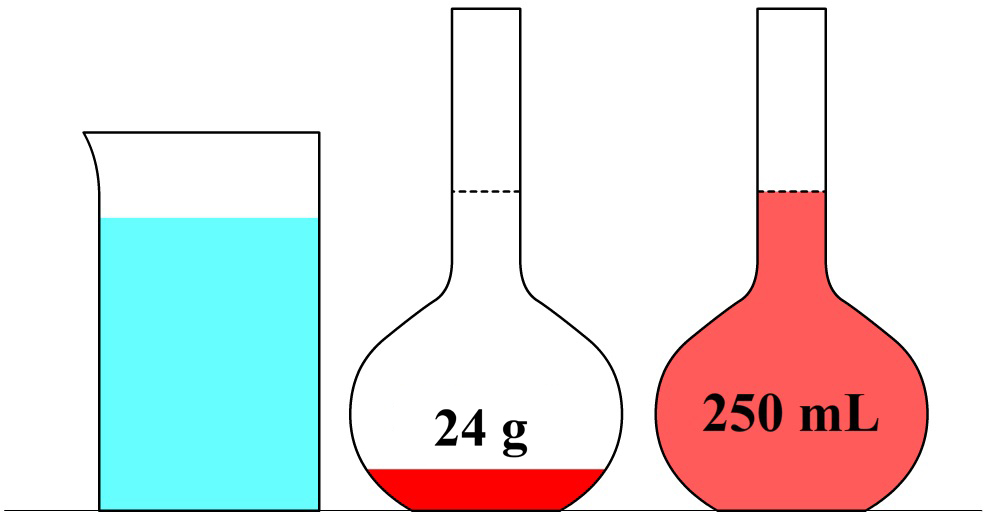
Laten we nu een iets complexere vraag oplossen. Stel we maken 1,2 L limonade met daarin 10 gram siroop en we hebben 0,15 L limonade met daarin 2 gram siroop. Welke limonade smaakt zoeter?
We kunnen deze vraag beantwoorden door de gegevens te noteren in een verhoudingstabel. De eerste soort limonade bevat 10 gram siroop en heeft een volume van 1,2 liter. Als we de concentratie van deze limonade willen weten, dan willen we weten hoeveel gram siroop er in 1 liter van deze limonade opgelost zit. Door kruislings te vermenigvuldigen vinden we dan:
| Massa siroop | 10 g | 8,3 g |
| Volume limonade | 1,2 L | 1 L |
Deze limonade heeft dus een concentratie van 8,3 g/L.
Op dezelfde manier vinden we de concentratie van het tweede type limonade:
| Massa siroop | 2 g | 13,3 g |
| Volume limonade | 0,15 L | 1 L |
Deze limonade heeft dus een concentratie van 13,3 g/L.
Met deze gegevens zijn we in staat de vraag te beantwoorden. Omdat de tweede soort limonade een hogere concentratie heeft, smaakt deze limonade het zoetst.
Nog een laatste vraag. Stel dat we 2,5 L limonade hebben gemaakt met een concentratie van 34 g/L. Hoeveel gram siroop is er dan gebruikt om deze limonade te maken?
Een siroopconcentratie van 34 g/L betekent dat er 34 gram siroop gebruikt is voor een liter van deze limonade. Door kruislings te vermenigvuldigen vinden we dan:
| Massa siroop | 34 g | 85 g |
| Volume limonade | 1 L | 2,5 L |
Er is dus 85 gram siroop gebruikt voor de 2,5 L limonade.
 Zorg dat je kan rekenen met massa en volume
Zorg dat je kan rekenen met massa en volume
|
|
 Zorg dat je kan rekenen en redeneren met de concentratie in gram per liter
Zorg dat je kan rekenen en redeneren met de concentratie in gram per liter
|
|
§3 Volume- en massaprocent
In deze paragraaf gaan we leren concentraties weer te geven als procenten. Dit kan op twee manieren: als massaprocent en als volumeprocent.
Tot nu toe hebben we concentraties weergegeven in gram per liter. We kunnen concentraties echter ook weergeven in procenten. Er zijn twee manieren waarop we dit kunnen doen. Kijk bijvoorbeeld eens naar de volgende afbeelding. We zien een mengsel bestaande uit rode en gele deeltjes. Stel dat het totale volume van het mengsel 2,0 L is en dat het mengsel voor 0,50 L uit gele deeltjes bestaat. In dat geval weten de dat het mengsel voor 0,50 / 2,0 × 100 = 25% uit gele deeltjes bestaat. We zeggen dan dat de concentratie 25 volumeprocent is. We korten dit meestal af tot 25 vol%.

Naast het volume kunnen we ook naar de massa kijken. Stel dat ditzelfde mengsel een massa van 3,0 kg heeft en dat 1,0 kg uit gele deeltjes bestaat. 1,0 / 3,0 × 100 = 33,3% van de massa bestaat dan dus uit gele deeltjes. We zeggen dan dat de concentratie 33,3 massaprocent is. Afgekort gebruiken we hier gewoon het procentteken (dus 33,3%). Merk op dat we dus een andere waarde kunnen vinden voor het volumepercentage (25 vol%) en het massapercentage (33%).
Voorbeeld 1:
1,00 liter wijn bevat 12,0 vol% alcohol. Bereken hoeveel milliliter alcohol er in de fles zit.
Hiervoor gebruiken we weer een verhoudingstabel.
| Volume | 1,00 L | 0,120 L |
| Volumeprocent | 100 vol% | 12,0 vol% |
De fles bevat dus 0,120 L alcohol en dat is gelijk aan 120 mL.
Voorbeeld 2:
Aan 120 mL water is 8 mL siroop toegevoegd. Bereken de siroopconcentratie in volumeprocent.
We hebben in totaal 120 + 8 = 128 mL limonade. Dit is het totale volume, oftewel 100 vol%. Als we de verhoudingstabel invullen, vinden we:
| Volume | 128 mL | 8 mL |
| Volumeprocent | 100 vol% | 6,25 vol% |
De siroopconcentratie is dus 6,25 vol%.
Voorbeeld 3:
In 250 gram halvarine zit 40% vet. Bereken hoeveel gram vet er in de halvarine zit.
| Massa | 250 g | 100 g |
| Massaprocent | 100% | 40% |
Er zit dus 100 gram vet in de halvarine.
 Zorg dat je kan rekenen en redeneren met massaprocent en volumeprocent
Zorg dat je kan rekenen en redeneren met massaprocent en volumeprocent
|
|
§4 Oplosbaarheid en oplossnelheid
In deze paragraaf bestuderen we hoeveel gram je maximaal kan oplossen in een vloeistof en bestuderen we van welke factoren de oplossnelheid afhankelijk is.
Oplosbaarheid
Als we zoutkorrels in water leggen, dan trekken de watermoleculen de zoutdeeltjes los uit de zoutkorrels (zie de onderstaande afbeelding). Dit noemen we het oplossen van zout. Hoe meer zoutdeeltjes er echter opgelost zijn, hoe groter de kans wordt dat een zo'n zoutdeeltje weer tegen de korrel botst en daar weer aan vast komt te zitten. Als de hoeveelheid opgeloste zoutdeeltjes toeneemt, dan kan het gebeuren dat het aantal zoutdeeltjes dat loskomt van de korrel even groot wordt als het aantal zoutdeeltjes dat weer aan de korrel vast komt te zitten. Het resultaat is dat de zoutkorrel niet meer kleiner wordt. De zoutkorrels lossen dan dus niet verder op.
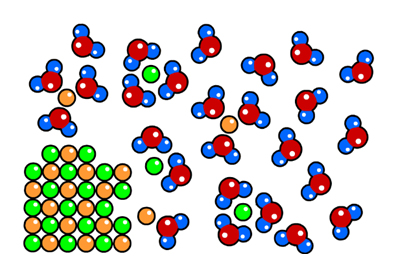
Er zit dus een maximum aan de hoeveelheid zout dat in een bepaalde hoeveelheid water kan worden opgelost. Bij een temperatuur van 25 °C kan je bijvoorbeeld maximaal 359 gram zout per liter water oplossen. Deze maximale hoeveelheid noemen we de oplosbaarheid. Zout heeft dus een oplosbaarheid van 359 g/L. Als je nog meer zout toevoegt, dan lost dit niet op, maar blijft het gewoon op de bodem liggen. Als de zoutconcentratie onder dit maximum zit, dan noemen we de oplossing onverzadigd. Als de limiet bereikt is, dan noemen we de oplossing verzadigd (zie de onderstaande afbeelding).
 (Afbeelding: Brandon Burghardt; PD)
(Afbeelding: Brandon Burghardt; PD)
De oplosbaarheid van stoffen is afhankelijk van de temperatuur. Voor vaste stoffen, zoals zout of suiker, neemt de oplosbaarheid toe als de temperatuur toeneemt. We kunnen dus meer van deze stoffen oplossen in warm water dan in koud water. Dit komt omdat bij hogere temperaturen de deeltjes sneller bewegen en de deeltjes dus gemakkelijk los komen.
Ook gassen kunnen oplossen in water. Je hebt bijvoorbeeld vast wel eens gehoord dat vissen zuurstof filteren uit het water met behulp van hun kieuwen. Dit betekent dus dat er zuurstof opgelost zit in het water. Als de temperatuur van het water toeneemt, dan gaan deze zuurstofmoleculen sneller bewegen en zo ontsnappen ze gemakkelijker uit de vloeistof. Bij gassen zorgt een hogere temperatuur dus voor een lagere oplosbaarheid.
Oplossnelheid
De oplosbaarheid vertelt ons hoeveel stof er maximaal opgelost kan worden, maar het zegt ons niets over hoe snel een stof oplost. Er zijn een aantal manieren om de oplossnelheid kunnen vergroten:
- door de oplossing te roeren.
- door de temperatuur te verhogen.
- door de verdelingsgraad te vergroten.
Roeren vergroot de oplossnelheid doordat de deeltjes zo beter met elkaar in aanraking komen. Als we suiker in water willen oplossen, zorgt roeren ervoor dat water beter in contact kan komen met de suiker. De temperatuur verhoogt de oplossnelheid doordat deeltjes met een hogere temperatuur sneller bewegen. Als gevolg botsen de waterdeeltjes sneller en krachtiger tegen de suikerdeeltjes.
De laatste factor waarmee we de oplossnelheid kunnen verhogen is de verdelingsgraad. De verdelingsgraad vertelt ons hoe goed een stof "verdeeld" is. De suikerdeeltjes in poedersuiker zijn bijvoorbeeld in kleinere stukjes verdeeld dan in kristalsuiker. Het gevolg is dat poedersuiker een veel groter oppervlak heeft dat in aanraking komt met het water en hierdoor lost het poedersuiker sneller op. In de onderstaande afbeelding wordt dit effect duidelijk. In de linker afbeelding komt zuurstof in aanraking met een blok met 16 centimeter aan omtrek. In de rechter afbeelding is het blok verdeeld in 16 stukken en komt zuurstof in aanraking met 64 centimeter aan omtrek. Dit is 4 keer zo veel!
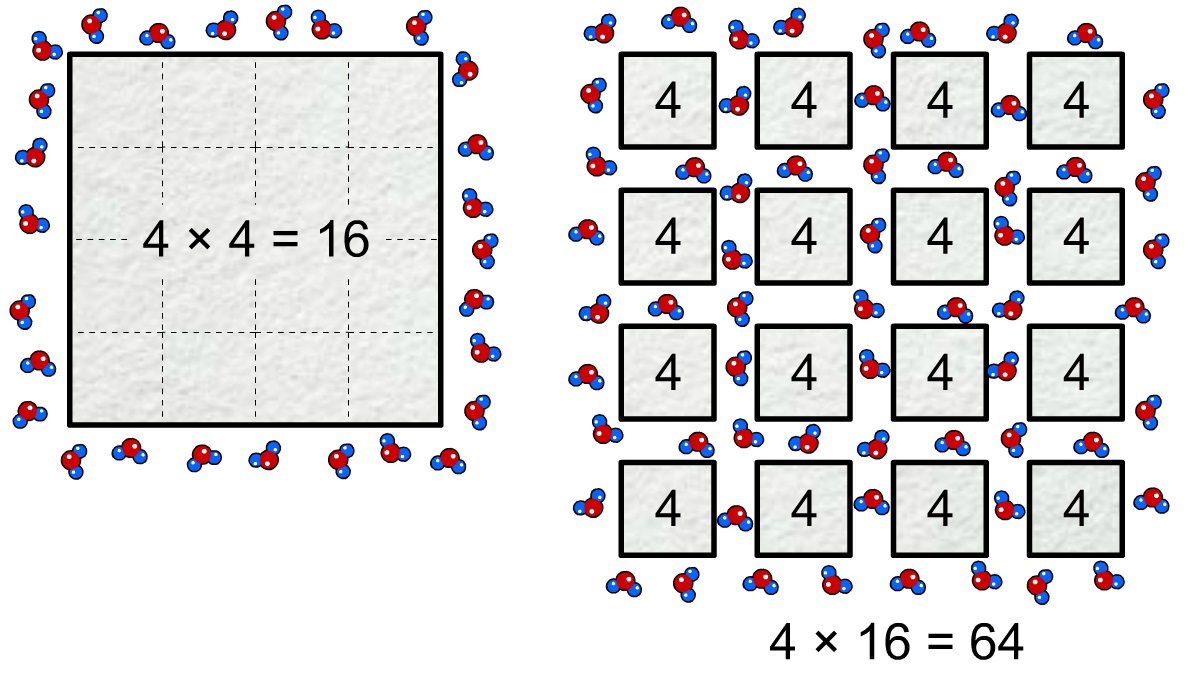
Roeren en het verhogen van de verdelingsgraad verhogen de oplossnelheid, maar bij deze ingrepen blijft de oplosbaarheid gelijk. De stof lost met deze technieken sneller op, maar er lost hierdoor niet een grotere hoeveelheid stof op. De temperatuur heeft wel effect op zowel de oplosbaarheid als de oplossnelheid. In warm water lost dus meer suiker op en het suiker lost ook nog eens sneller op.
| Invloed op de oplosbaarheid: | Invloed of de oplossnelheid: |
| Temperatuur | Temperatuur |
| Roeren | |
| Verdelingsgraad |
 Zorg dat je kan redeneren met de oplossnelheid en de oplosbaarheid
Zorg dat je kan redeneren met de oplossnelheid en de oplosbaarheid
| ||||||||||
| ||||||||||
 Zorg dat je kan rekenen met de oplosbaarheid
Zorg dat je kan rekenen met de oplosbaarheid
| ||||||||||
|