Hoofdstuk 3
Kwantumfysica
§1 Golf- en deeltjesverschijnselen §2 De Broglie §3 Deeltje in een doos §4 Het atoommodel §5 Onzekerheid §6 Tunneling
§1 Golf- en deeltjesverschijnselen
De kwantumfysica geeft ons een zeer nauwkeurige beschrijving van de kleine deeltjes waaruit de wereld bestaat. Een aantal experimenten in de 19de eeuw lieten onmiskenbaar zien dat licht golfeigenschappen had. Maar toen liet Einstein zien dat licht ook deeltjeseigenschappen had. Dus is licht nu een golf of een deeltje of misschien een combinatie van beide? Hierover gaan we het hebben in dit hoofdstuk.
Laten we beginnen met Einsteins ontdekking dat licht uit deeltjes bestaat. Als we licht op metaalatomen schijnen, dan kan dit licht geabsorbeerd worden door de elektronen in deze atomen. In sommige gevallen heeft het licht genoeg energie om elektronen uit de atomen te trekken. De elektronen schieten dan weg van de metaalatomen. Dit wordt het foto-elektrisch effect genoemd. Als licht uit golven bestaat, dan zou men hier verwachten dat het ontsnappen van de elektronen zou moeten afhangen van de intensiteit (en dus van de amplitude) van deze golven. Volgens deze theorie zou elke kleur licht elektronen moeten kunnen laten ontsnappen uit het metaal, als we het licht maar fel genoeg maken. In de onderstaande afbeelding zien we dat zowel rood als blauw licht elektronen kan vrijmaken, mits de intensiteit van het licht maar groot genoeg is.
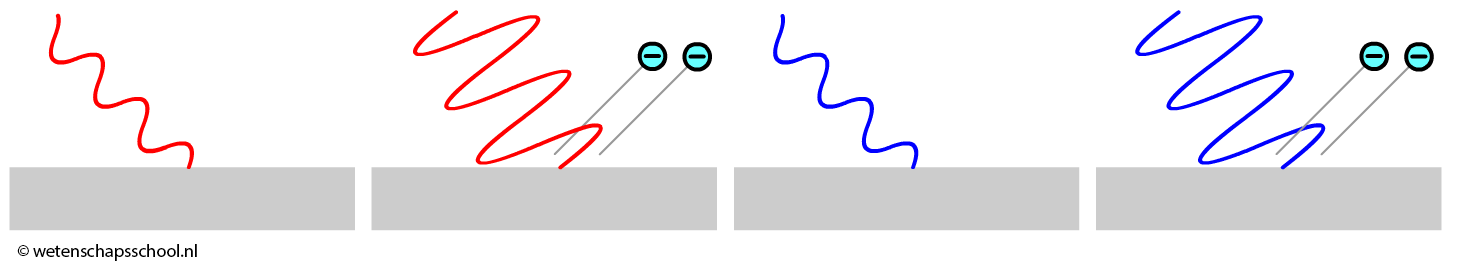
In werkelijkheid bleek dit echter niet het geval! In plaats van de intensiteit, bleek de frequentie (en dus de kleur) van het licht het verschil te maken. Als de frequentie boven de zogenaamde grensfrequentie (fgrens) komt (of onder de grensgolflengte λgrens), dan ontsnappen de elektronen en anders niet. De intensiteit heeft hier geen invloed op. Hoe hoger de intensiteit, uit hoe meer fotonen het licht bestaat, maar als elk afzonderlijk foton niet genoeg energie heeft, dan zal geen van deze fotonen in staat zijn een elektron te laten ontsnappen.
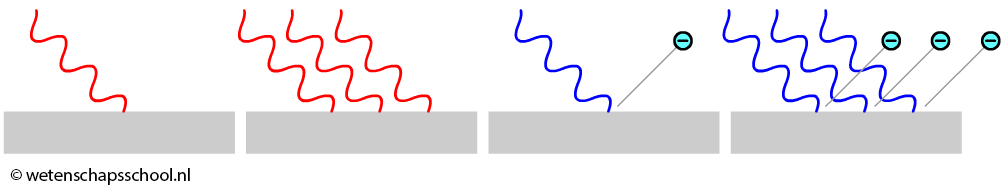
Einstein concludeerde op basis van deze observatie dat licht behalve golf- ook deeltjeseigenschappen heeft. Volgens Einstein was licht opgebouwd uit kleine deeltjes genaamd fotonen. Als de lichtgolf het metaal raakt, dan is het niet de gehele golf die geabsorbeerd wordt, maar de individuele fotonen waaruit het licht bestaat. Als een enkel foton genoeg energie heeft, dan zal het elektron ontsnappen uit het atoom en anders niet. De intensiteit heeft hier geen invloed op. Hoe hoger de intensiteit, hoe meer fotonen, maar als elk afzonderlijk foton niet genoeg energie heeft, dan zal geen van deze fotonen in staat zijn een elektron te laten ontsnappen.
 Demonstratievideo
Demonstratievideo
| ||
|
Bij het foto-elektrisch effect moet het foton in ieder geval genoeg energie hebben om het elektron uit het metaal te trekken. Deze energie wordt de uittree-energie (Euittree) of ook wel de ionisatie-energie genoemd. De uittree-energie is voor verschillende stoffen in BINAS te vinden. Als er dan nog energie over is, dan wordt deze energie meegegeven aan het elektron in de vorm van kinetische energie. Dit is de energie waarmee het elektron wegschiet uit het materiaal. Er geldt dus:
|
$$E_{foton} = E_{uittree} + E_{kin} \;\;\; \text{(bij ontsnappen elektron)}$$
|
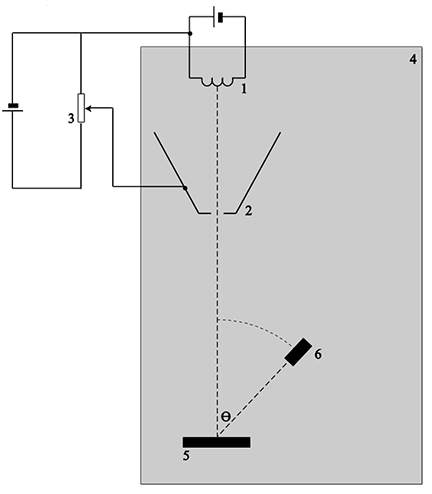
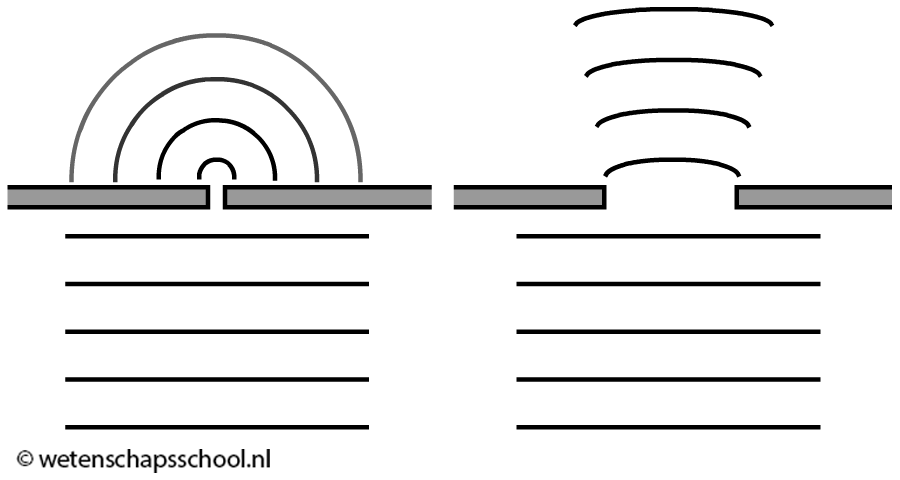
We kunnen als volgt aantonen dat licht ook golfeigenschappen heeft. Bij het zogenaamde dubbele spleet experiment schijnen we licht op een plaatje met twee dunne spleetjes. Achter elke spleet vormen dan cirkelvormige golven. We noemen de formule die deze golven beschrijft de golffunctie. Zoals we in het hoofdstuk "Trillingen" geleerd hebben, gaan deze golven met elkaar interfereren (zie de onderstaande linker afbeelding). Als we achter het scherm een detector plaatsen, dan zien we op dit scherm maxima en minima zoals we dat ook in het hoofdstuk “Trillingen” gezien hebben. Het interferentiepatroon is een aanwijzing dat licht een golf is. Als licht uit deeltjes zou bestaan, dan zouden we het rechter patroon verwachten. We zouden in dat geval alleen deeltjes meten op de plekken achter de twee spleetjes. Als we dit experiment echter uitvoeren, dan vinden we het linker resultaat. Dit is merkwaardig, aangezien Einstein juist gevonden had dat licht uit deeltjes bestaat. Als gevolg spreken we van de golf-deeltje-dualiteit.
Maar het wordt nog vreemder. Als we de individuele fotonen volgen om te zien hoe ze bewegen, dan krijgen we wel het rechter patroon te zien! Als we niet meten, dan gedraagt licht zich dus als een golf en als we wel meten, dan bestaat licht plotseling uit losse deeltjes.

We kunnen ook fotonen één voor één door de spleten sturen zonder te meten door welke spleet ze gaan. In de onderstaande afbeelding zien we wat er in dat geval gebeurt. Ten eerste zien we dat de fotonen op specifieke punten op de detector terecht komen. Dit suggereert dat fotonen deeltjes zijn. Maar als we lang genoeg wachten, dan zien we een interferentiepatroon ontstaan. Dit suggereert juist dat fotonen golven zijn. Een dergelijk interferentiepatroon kan alleen ontstaan als elk foton door beide spleten is gegaan en met zichzelf interfereert! Het moment dat de golf echter tegen de detector botst, verschijnt het foton als een puntje op het scherm, alsof het juist een deeltje is! De golf is op dat moment dus ineen geklapt tot een deeltje. Dit lijkt onlogisch, maar toch is dit wat we meten. Als gevolg wordt vaak gezegd: "Wie zegt de kwantumfysica te begrijpen, heeft het niet begrepen".

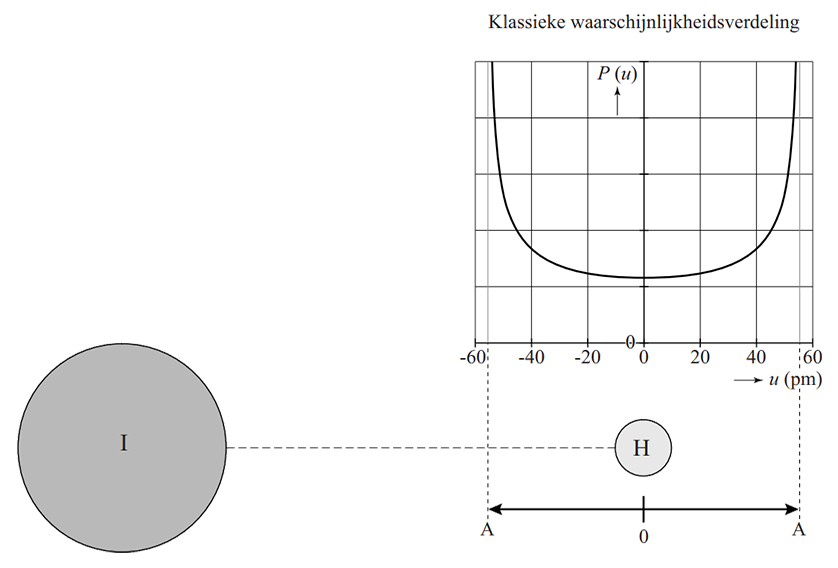
Maar wat bepaalt dan waar het foton op de detector terecht komt? Dit blijkt niet te voorspellen. Het is niet mogelijk van te voren uit te vinden waar het foton op het scherm zal komen. Het enige dat we weten, is dat als je genoeg fotonen afschiet, dat dan een voorspelbaar interferentiepatroon ontstaat. Bij de maxima is de kans op een foton het grootst en bij de minima is er geen kans het foton te vinden. De kwantumfysica is dus gebaseerd op kans en het interferentiepatroon vertelt ons hoe groot deze kans is. We noemen dit patroon daarom ook wel een waarschijnlijkheidsverdeling (P). Hieronder zien we een afbeelding van de waarschijnlijkheidsverdeling die bij dit experiment hoort.
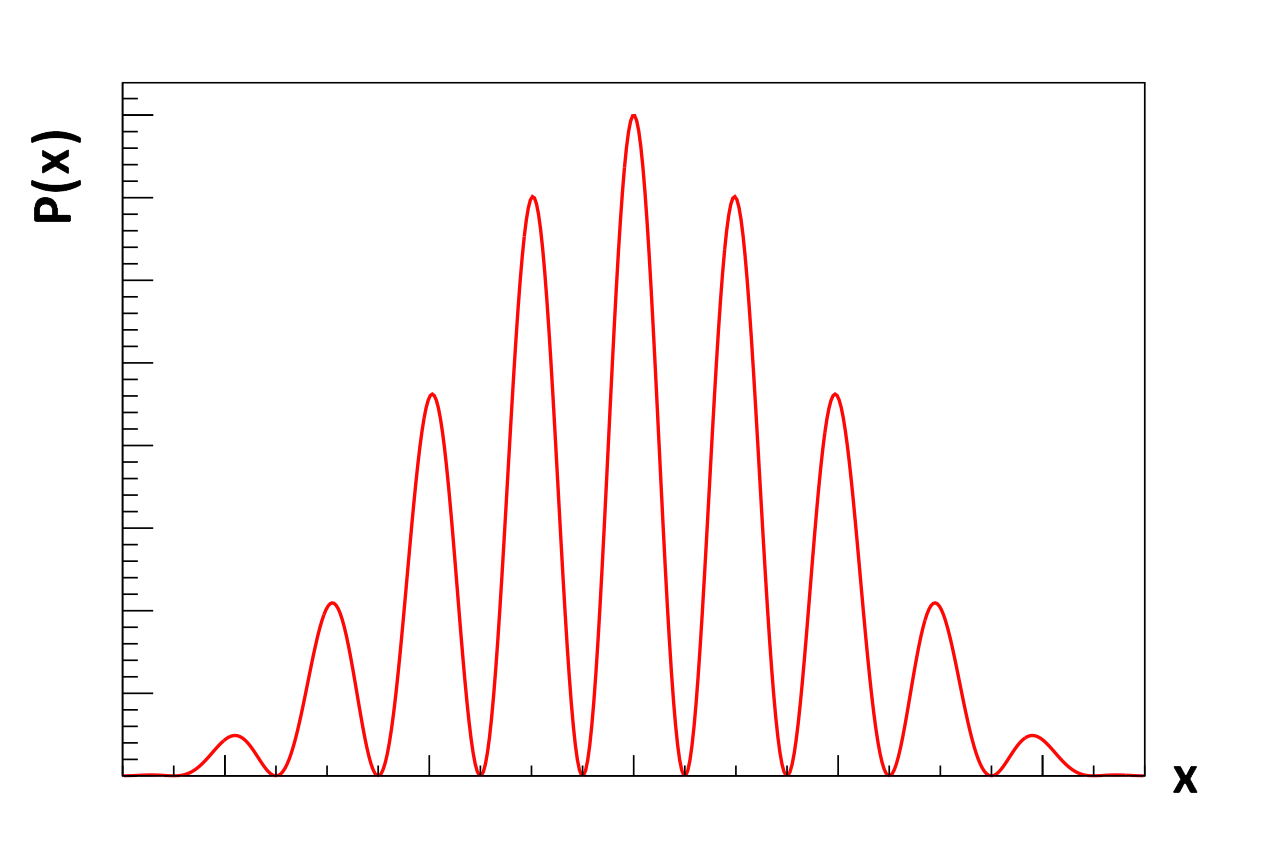
Als je de kans wil vinden dat je een elektron in een bepaald gebiedje zal aantreffen, dan doe je dat door de oppervlakte onder de grafiek te bepalen. Het totale oppervlak onder de grafiek is altijd 1, oftewel 100%. Als je overal zoekt, heb je namelijk zekerheid dat je het elektron ergens zal vinden.
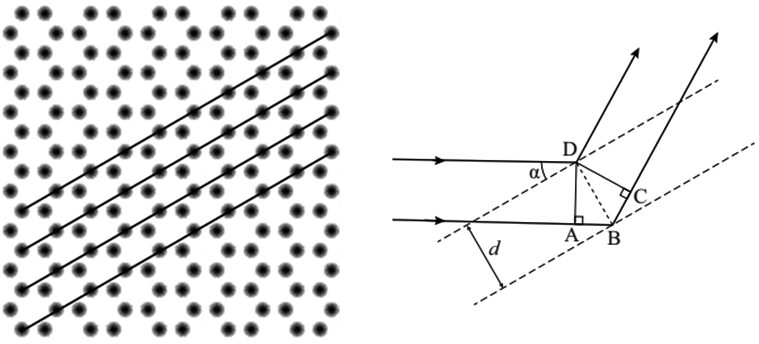
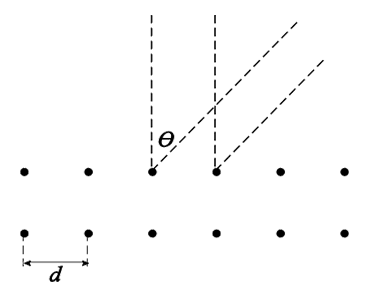
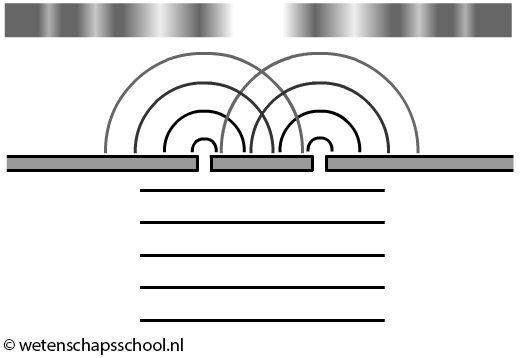
Met behulp van de onderstaande afbeelding gaan we begrijpen hoe het interferentiepatroon vormt. We zien hier een golf die aankomt bij een plaat met daarin twee spleten. Achter elke spleet vormt dan een cirkelvormige golf. In punt B is de weglengte van beide golven gelijk en als gevolg is het weglengteverschil nul en komen de golven dus in fase aan (zie hoofdstuk "Trillingen"). Hier bevindt zich dus een maximum. We noemen dit het nulde orde maximum.
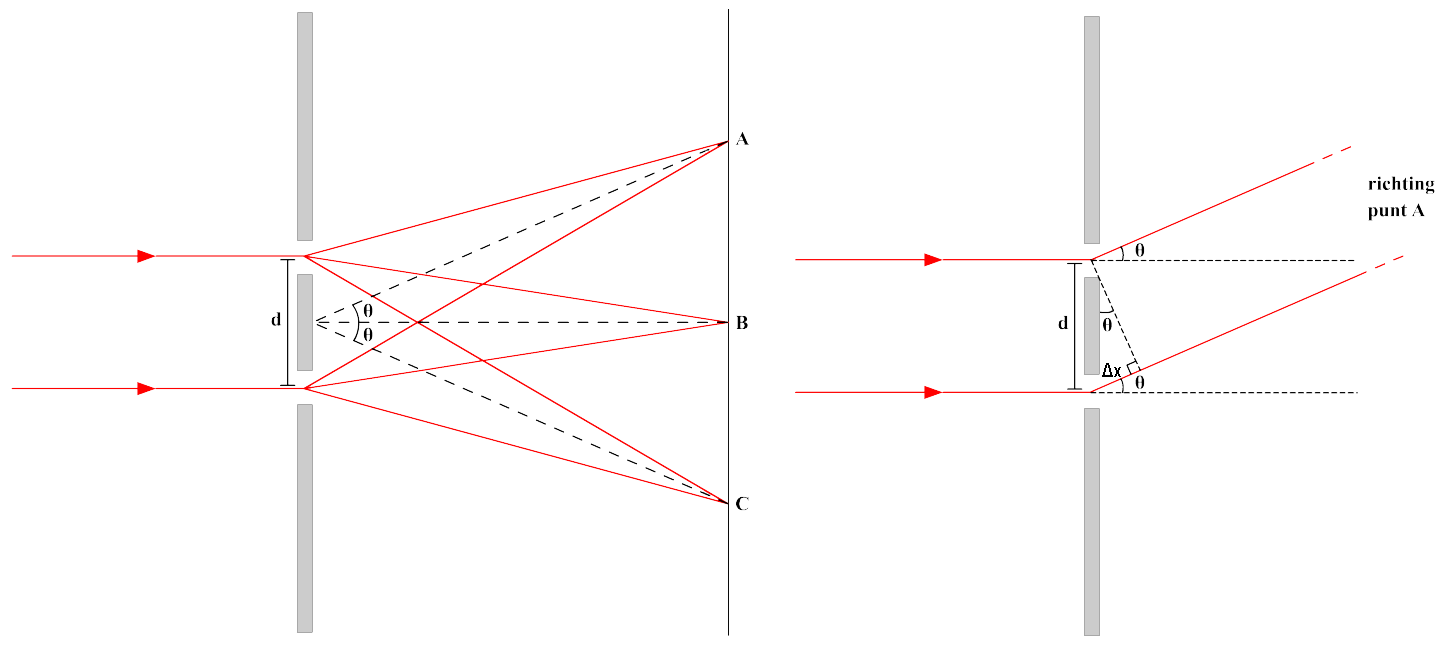
De eerstvolgende maxima bevinden zich bij punt A en C. We noemen dit de eerste orde maxima. Rechts zien we een close-up van de twee golven die aankomen in punt A. Het weglengteverschil tussen de twee lichtstralen die bij punt A uitkomen is in deze afbeelding Δx genoemd. In de afbeelding is te zien dat deze afstand een zijde van een driehoek is waarvoor geldt:
$$ \sin{\theta} = \frac{\Delta x}{d} $$Zoals je je misschien nog kan herinneren uit het hoofdstuk "Trillingen" geldt dat constructieve interferentie optreedt als er precies een heel aantal golflengtes in dit weglengteverschil (Δx) passen. Op deze manier komen de golven namelijk in fase aan bij de detector. Er geldt dus: Δx = nλ, waarbij n een heel getal is. Als we deze twee formules combineren, dan vinden we:
$$n\lambda = d\sin{\theta}$$
|
Let op dat de formule niet bij elke waarde van n een hoek θ oplevert. Bij een te hoge n geeft de rekenmachine een "error". Door te kijken wanneer deze error optreedt kan je gemakkelijk het aantal orden bepalen dat zichtbaar is bij een dubbelspleet (zie het onderstaande voorbeeld).
Dezelfde formule geldt ook voor een zogenaamde tralie. Dit is een plaatje met daarin niet twee maar een hele hoop spleten. Het voordeel van een tralie is dat op veel meer punten destructieve interferentie voorkomt, waardoor de pieken van het interferentiepatroon dunner en feller worden (zie de onderstaande afbeelding).
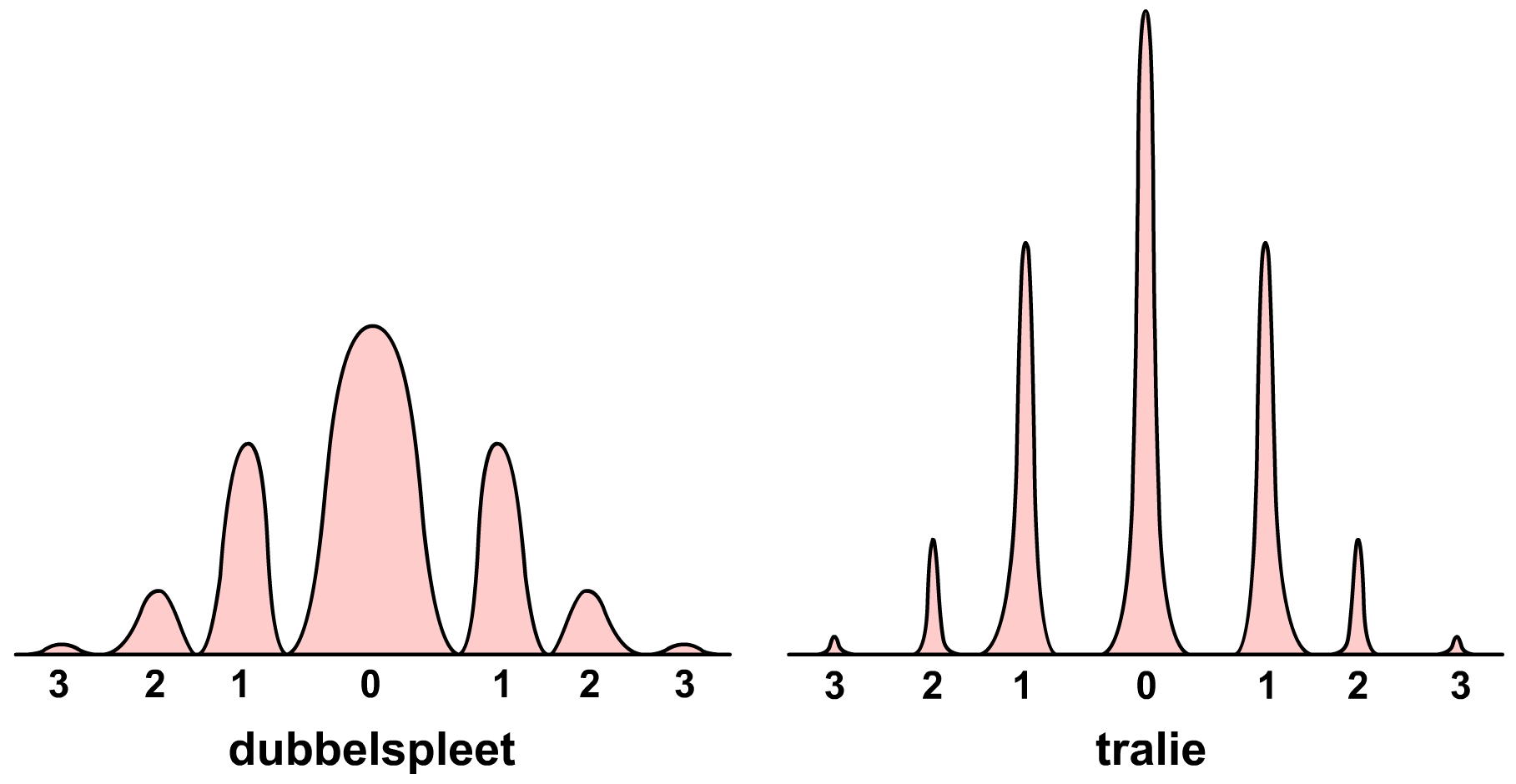
Dit werkt als volgt. Doordat er achter elke spleet een golfje ontstaat, hebben we bij een tralie veel meer golven en dus ook meer mogelijkheden voor destructieve interferentie. Neem bijvoorbeeld de golven in de rechter afbeelding. Golf A en B zorgen niet voor destructieve interferentie, maar golven A en C wel. Omdat tralies honderden spleten per millimeter kunnen hebben, zorgt dit voor zoveel destructieve interferentie dat alleen de punten heel dicht bij de maxima nog oplichten.

 Demonstratievideo
Demonstratievideo
| ||
|
 Voorbeeld
Voorbeeld
|
|
Vraag: Een rode laser wordt door een tralie geschenen met 500 spleten per millimeter. Als gevolg worden 5 stippen zichtbaar op een muur. De eerste orde bevindt zich onder een hoek van 20,5o. Bereken hiermee de frequentie van het gebruikte laserlicht.
Antwoord: 500 spleten per millimeter geeft ons een afstand tussen de spleten gelijk aan: d = 0,001 / 500 = 2,0 × 10-6 m Hiermee berekenen we de golflengte bij n = 1: $$n\lambda = d\sin{\theta}$$ $$\lambda = \frac{d\sin{\theta}}{n}$$ $$\lambda = \frac{2,0 \times 10^{-6} \sin{20,5^\circ}}{1} = 700 \text{ nm}$$Volgens BINAS komt dit inderdaad overeen met rood licht. Vraag: Antwoord: Bij het omschrijven van de formule gebruiken we de inverse sinus, ook wel de arcsinus genoemd: $$ \theta = \arcsin{\frac{n\lambda}{d}} $$ $$ \theta = \arcsin{\frac{3 \times 530 \times 10^{-9}}{2,0 \times 10^{-6}}} = 52,7^\circ $$Nu proberen we "n = 4". Hier vinden we: $$ \theta = \arcsin{\frac{4 \times 530 \times 10^{-9}}{2,0 \times 10^{-6}}} = \arcsin{1,06} = \text{error!} $$Bij "n = 4" vinden we dus een "error". Dit gebeurt als we de arcsinus nemen van een waarde boven de 1 of onder de -1. Bij dit groene licht zijn dus drie orden zichtbaar. Inclusief de 0de orde zorgt dit voor 3 × 2 + 1 = 7 stippen op de muur.
|
Met de onderstaande animatie kunnen we golf- en deeltjesverschijnselen beter begrijpen. Als je de slider helemaal naar links sleept, dan zien we aan de linkerkant een kwantumgolf met een nauwkeurig te bepalen golflengte, maar de positie van de golf is onzeker. Het deeltje kan zich overal in de ruimte bevinden. De golffunctie gedraagt zich hier dus als een golf. Als we de schuif meer naar rechts slepen, dan wordt de positie steeds beter te bepalen. Door de duidelijke positie gedraagt de golffunctie zich hier als een deeltje. De golflengte is nu juist onzeker. Een dergelijke golf is namelijk te maken door een heel aantal sinussen met verschillende golflengtes bij elkaar op te tellen. In de rechter afbeelding zijn de sinussen zichtbaar die hiervoor gebruikt zijn. We hebben hier dus niet te maken met één golflengte, maar met een hele serie. Door de duidelijke positie van de golffunctie gedraagt het zich hier als een deeltje.
Elk deeltje kan dus óf deeltjeseigenschappen óf golfeigenschappen vertonen, maar nooit allebei tegelijk. Dit idee wordt de onzekerheidsrelatie of ook wel de onbepaaldheidsrelatie van Heisenberg genoemd. Belangrijk is te realiseren dat deze onzekerheid in de positie en de golflengte niet ontstaat omdat onze meetinstrumenten niet goed genoeg zijn, maar omdat deeltjes en golven tegenstrijdige kenmerken hebben die niet tegelijk kunnen bestaan. In het dagelijks leven merken we echter weinig van deze onzekerheid, door de extreem kleine golflengte van deze deeltjes.
De onzekerheidsrelatie speelt o.a. een grote rol bij elektronen in atomen. Door de kleine massa van een elektron, is de onzekerheid in de positie relatief groot. Als gevolg is de golffunctie van het elektron vaak in dezelfde orde van grootte als het hele atoom. Als we over elektronen in atomen spreken, spreken we daarom vaak van een elektronenwolk. De atoomkern heeft een veel grotere massa en als gevolg is de onzekerheid in de positie veel kleiner.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
NIEUWE VRAAG 2025-2026: Hieronder is de waarschijnlijkheidsverdeling van een elektron te zien.
NIEUWE VRAAG 2025-2026: (2p) We spreken bij atomen vaak over een "elektronenwolk". Leg dit uit met behulp van de onzekerheidsrelatie. En leg uit waarom we bij een atoomkern meestal niet over een "wolk" spreken. NIEUWE VRAAG 2025-2026: (1p) Een gepulste laser bestaat niet uit een continue stroom van fotonen, maar uit pakketjes van fotonen. Omdat elk foton zich in een pakketje bevindt, is de onbepaaldheid in de plaats waar hij zich bevindt gelijk aan de lengte van het pakketje.
|
§2 De Broglie
In de vorige paragraaf hebben we gezien dat licht zowel deeltjes- als golfeigenschappen heeft. Hetzelfde bleek ook te gelden voor deeltjes met massa, zoals elektronen en protonen. De Broglie vond één vergelijking, waarmee zowel de golflengte van deeltjes met als zonder massa gegeven kan worden. In deze paragraaf introduceren we deze formule.
Het dubbele spleet experiment dat in de vorige paragraaf beschreven is, werd op een later moment ook uitgevoerd voor deeltjes met massa, zoals elektronen, protonen en zelfs hele moleculen. In alle gevallen vonden we hetzelfde resultaat als bij fotonen. Ook deeltjes met massa hebben dus zowel golf- als deeltjeseigenschappen. Een massief deeltje als een elektron kunnen we dus ook voorstellen als een golfje en moet dus ook een golflengte hebben.
De natuurkundige De Broglie vond een formule waarmee de golflengte van deeltjes met en zonder massa gegeven kan worden. Hiervoor is het begrip impuls (p) nodig. In de relativiteitstheorie was bekend dat de impuls voor deeltjes zonder massa (zoals fotonen) gegeven wordt door "E = pc". Voor deeltjes met massa had Newton al gevonden dat:
$$p = mv$$
|
Door de formule "Ef = pc" en "Ef = hc / λ" te combineren, vond de wetenschapper Louis de Broglie één formule waarmee de golflengte te vinden is voor zowel deeltjes met als zonder massa. We noemen dit de debroglie-golflengte:
$$\lambda = \frac{h}{p}$$
|
Omdat de impuls zo vaak gebruikt wordt in de kwantummechanica, gaan we de formule voor de kinetische energie als volgt herschrijven:
$$E_{kin} = \frac{p^2}{2m}$$
|
Als we deze formule uitschrijven met "p = mv", dan vinden we:
$$ E_{kin}= \frac{m^2v^2}{2m}= \frac{mv^2}{2} = \frac{1}{2}mv^2 $$Zoals je ziet vinden we hier de formule voor de kinetische energie terug.
In het dagelijks leven merken we meestal weinig van de golfeigenschappen van deeltjes. Dit komt doordat de constante van Planck (h) in de formule van de Broglie erg klein is. Aan de formule "λ = h/p" zien we dat de golflengte hierdoor erg klein wordt (behalve als de impuls extreem klein is).
De formule van de Broglie speelt o.a. een rol in de microscopie. Om dit te begrijpen moeten we eerst een begrip bespreken genaamd buiging, ook wel diffractie genoemd. Golven buigen namelijk om voorwerpen heen. Bij geluid kennen we dit effect allemaal. We kunnen bijvoorbeeld iemand horen die om een hoek staat, omdat het geluid de hoek om buigt.
Hieronder zien we golven die zich door een dunne en een brede spleet bewegen. Als de spleet klein is ten opzichte van de golflengte, dan treedt veel buiging op. Zo niet, dan treedt juist weinig buiging op. Bij een erg brede spleet vindt bijna helemaal geen buiging plaats. Dankzij de kleine golflengte van zichtbaar licht, merken we weinig van het buigen van licht in het dagelijks leven. Voor radiogolven is dit echter een ander verhaal. Radiogolven hebben een veel grotere golflengte en buigen daarom gemakkelijk om alledaagse voorwerpen heen. Dit is waarom een radio bijna overal ontvangst heeft. De radiostraling buigt zich om alle voorwerpen heen en komt zo in alle uithoeken terecht.
In de onderstaande afbeelding wordt een voorwerp beschenen met licht. Ook hier treedt buiging op. Als het voorwerp klein is ten opzichte van de golflengte, dan treedt veel buiging op. Zo niet, dan vindt weinig buiging plaats. Links in de afbeelding treedt dus weinig buiging op en als gevolg is er achter het voorwerp een duidelijke schaduw te zien. Rechts is de buiging zo extreem dat de golven hun pad vervolgen alsof er helemaal geen voorwerp aanwezig is.
Dit effect zorgt voor een limiet bij het gebruik van lichtmicroscopen. Als de golflengte van zichtbaar licht groter is dan het voorwerp dat je wilt bekijken, dan krijg je door buiging geen goed beeld. Bij erg kleine voorwerpen moet dus een ander type microscoop gebruikt worden. Een voorbeeld is een elektronenmicroscoop. Stel dat de elektronen in dit type microscoop met een snelheid van 2,3 × 105 m/s worden afgeschoten op het voorwerp dat we willen bekijken, dan vinden we de volgende debroglie-golflengte:
$$\lambda = \frac{h}{p} = \frac{h}{mv}$$ $$ \lambda = \frac{6,6261 \times 10^{-34}}{9,31\times 10^{-31} \times 2,3 \times 10^5}=3,0 \;\text{nm} $$Dit is klein genoeg om bijvoorbeeld een virus te kunnen bekijken, hetgeen met een normale microscoop niet mogelijk is.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§3 Deeltje in een doos
Om kwantumeffecten beter te begrijpen, bestuderen we in deze paragraaf het simpelste kwantumsysteem: het deeltje in een doos.
In deze paragraaf bestuderen we een deeltje dat alleen naar links en rechts kan bewegen in een één-dimensionale ruimte die aan beide zijden is afgesloten (zie de onderstaande afbeelding). We noemen systeem ook wel het deeltje in een doos. Omdat de wanden van dit systeem gezien worden als oneindig sterk, spreken we hier ook wel van de oneindig diepe energieput (dat wil zeggen, een energieput waaruit het deeltje niet kan ontsnappen).

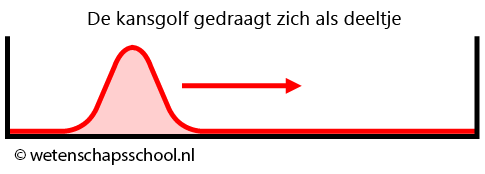
Als de doos groot is ten opzichte van de golffunctie van het deeltje, dan zal de golf zich als een deeltje gedragen. De kansgolf zal dan heen en weer botsen in het doosje alsof het een deeltje is (zie de onderstaande afbeelding).
Als de doos echter klein is ten opzichte van de kansgolf, dan beginnen we golfverschijnselen te merken. Als de golf reflecteert tegen de wanden, dan begint deze namelijk met zichzelf te interfereren. Net als bij trillingen in een snaar ontstaat hierbij dan een staande golf met knopen en buiken. Net als bij een snaar geldt dan ook:
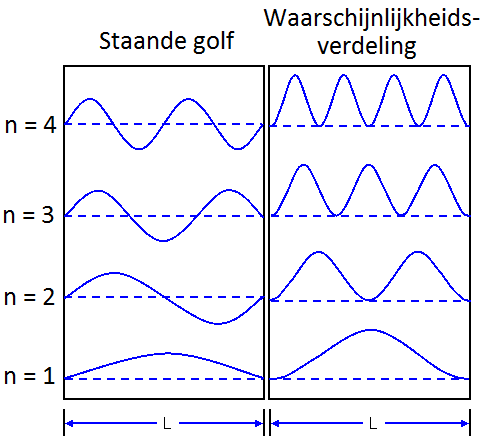
$$L = \frac{1}{2}\lambda n \;\;\;\; \text{(twee vaste uiteinden)}$$In het geval van een deeltje in een doos noemen we "n = 1" de grondtoestand en "n = 2, 3, ... " de aangeslagen toestanden. "n = 2" noemen we de eerste aangeslagen toestand. "n = 3" noemen we de tweede aangeslagen toestand. Etc. Hieronder zien we links de golffunctie bij een aantal toestanden van een deeltje in het doosje. Uit metingen is gebleken dat het kwadraat van de golffunctie gelijk is aan de waarschijnlijkheidsverdeling (P) die we eerder in het hoofdstuk besproken hebben. Deze verdelingen zijn rechts in de onderstaande afbeelding weergegeven. Merk op dat door het kwadraat de kansverdeling overal positief is geworden. Dit is maar goed ook, want negatieve kansen bestaan niet.
Als we de formule "L = ½ λn" combineren met "λ = h/p", dan vinden we:
$$p=nh/2L$$Als we deze formule combineren met "Ekin = p2/(2m)", dan vinden we:
$$E_{kin,n} = \frac{n^2h^2}{8mL^2}$$
|
Een aantal dingen kunnen we aan deze formule opmerken. Ten eerste zien we dat het elektron in het doosje niet zomaar elke kinetische energie (en dus niet elke snelheid) kan aannemen. Alleen de waarden die overeenkomen met de staande golven zijn mogelijk. We zeggen daarom dat de energie gekwantiseerd is. Merk ook op dat het niet mogelijk is dat het deeltje geen kinetische energie heeft. Zelfs in de grondtoestand "n = 1", de laagste toestand, heeft het deeltje namelijk volgens de formule nog gewoon energie. We noemen dit de nulpuntsenergie. Een deeltje in een doos kan dus niet stilstaan!
Als de lengte L van de doos groot wordt, dan kan je aan de formule zien dat de energieniveaus erg dicht op elkaar komen te liggen. Op een gegeven moment komen deze niveaus zo dicht bij elkaar te liggen dat het lijkt alsof het deeltje gewoon alle energieniveaus kan aannemen. Dit is waarom we in het dagelijks leven niks merken van de kwantisering.
Een deeltje in een doosje kan naar een hoger energieniveau springen door o.a. een foton te absorberen met een energie die precies overeenkomt met het verschil tussen het huidige energieniveau en een hoger niveau. Er geldt dus:
$$E_{foton} = \Delta E_n$$
|
Dezelfde formule geldt als een elektron terugvalt naar een lager niveau. In dat geval komt er juist een foton vrij. Stel dat een elektron in een doosje met een lengte van 2,0 nm terugvalt van de eerste aangeslagen toestand naar de grondtoestand. Er geldt dan:
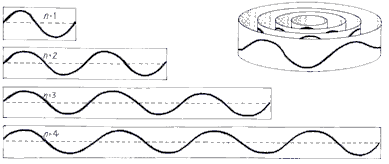
$$E_{foton} = \Delta E_n = E_2 - E_1$$ $$E_{foton} = \frac{2^2h^2}{8mL^2} - \frac{1^2h^2}{8mL^2}$$ $$E_{foton} = \frac{3h^2}{8mL^2}$$ $$E_{foton} = \frac{3 \times (6,6261 \times 10^{-34})^2}{8 \times 9,109 \times 10^{-31} \times (2,0 \times 10^{-9})^2} = 4,5 \times 10^{-20} \text{ J} = 0,28 \text{ eV}$$Hieronder zien we een praktijkvoorbeeld van staande elektrongolven. Een aantal ijzeratomen zijn in een cirkel geplaatst en vormen zo een tweedimensionaal "doosje". De elektronen van een daaronder gelegen laag koperatomen interfereren met elkaar en vormen zo een staande golf
 (Afbeelding: Julian Voss-Andreae; CC BY-SA 3.0; Afbeelding is een reproductie van een afbeelding gemaakt door Don Eigler, IBM Almaden Research Center)
(Afbeelding: Julian Voss-Andreae; CC BY-SA 3.0; Afbeelding is een reproductie van een afbeelding gemaakt door Don Eigler, IBM Almaden Research Center)
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§4 Het atoommodel
Met de kwantumfysica kunnen we ook het waterstofatoom en zelfs het gehele periodiek systeem beschrijven. In deze paragraaf gaan we zien hoe dit werkt.
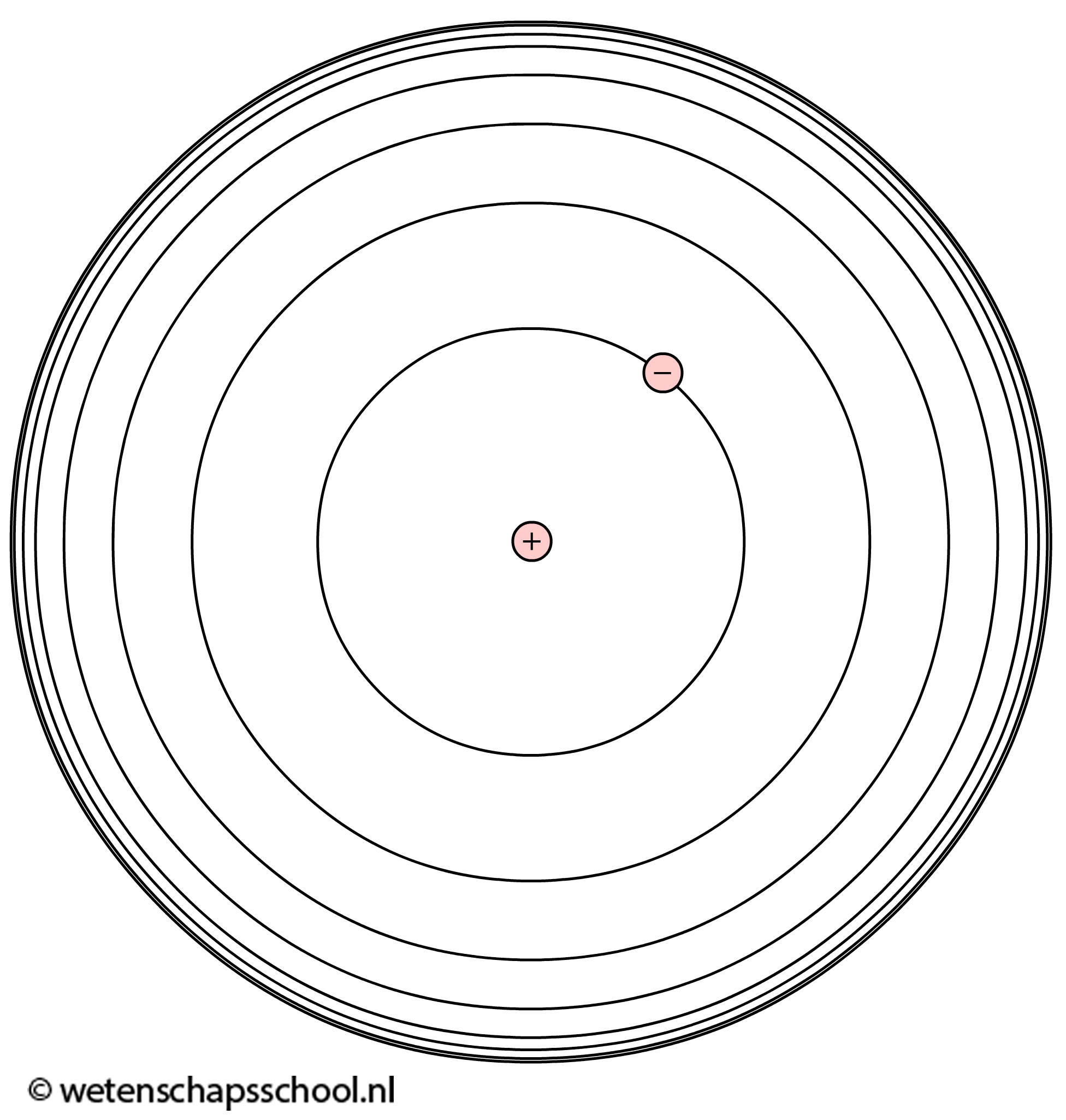
De kwantummechanische beschrijving van het waterstofatoom wordt ook wel het atoommodel van Bohr genoemd. Net als in het geval van het deeltje in een doos, kan ook het elektron in een waterstofatoom gezien worden als een staande golf. Ook het elektron in waterstof kan zich in de grondtoestand of één van de aangeslagen toestanden bevinden. In elke toestand bevindt het elektron zich in een andere schil om de kern (zie de onderstaande afbeelding).
In elke schil heeft het elektron een specifieke energie. Deze energie bestaat uit een combinatie van kinetische en elektrische energie. In een opdracht onder aan deze paragraaf zullen we bewijzen dat de energieniveaus die bij deze toestanden horen gegeven worden door:
$$E_n(\text{eV}) = \frac{-13,6}{n^2} \;\;\;\; \text{(waterstofatoom, energie in eV)}$$
|
Merk op dat de energie in deze formule in elektronvolt is gegeven. De energieniveaus uit de formule zijn hieronder ook schematisch weergegeven. Deze afbeelding is ook te vinden in BINAS.
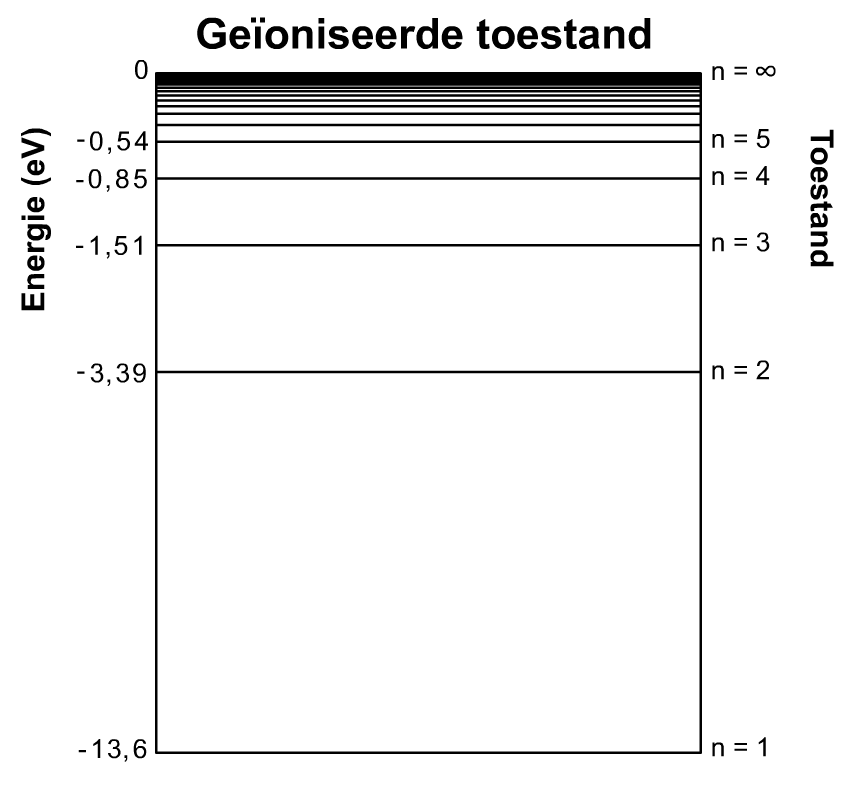
Zowel in de formule als in het diagram zien we dat het elektron in zijn grondtoestand (n = 1) een energie heeft van -13,6 eV. Het elektron ontsnapt dus als het een foton absorbeert van boven de 13,6 eV. In dat geval zeggen we dat het waterstof atoom geïoniseerd is. De ionisatie- of uittree-energie van waterstof is dus gelijk aan 13,6 eV.
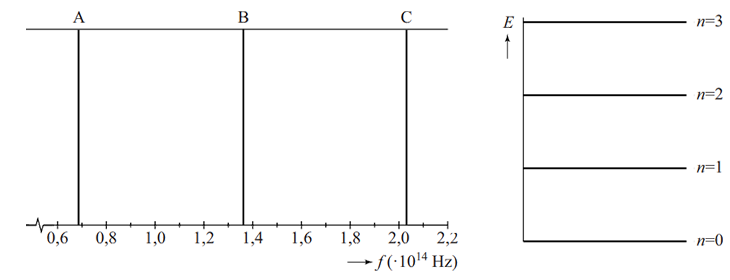
Net als bij het deeltje in het doosje, kan een elektron in waterstof verspringen naar een hoger energieniveau door een foton op te nemen en kan het elektron verspringen naar een lager niveau door dit foton weer uit te zenden. Bij een overgang van "n = 3" naar "n = 2" komt bijvoorbeeld een foton vrij met de volgende energie:
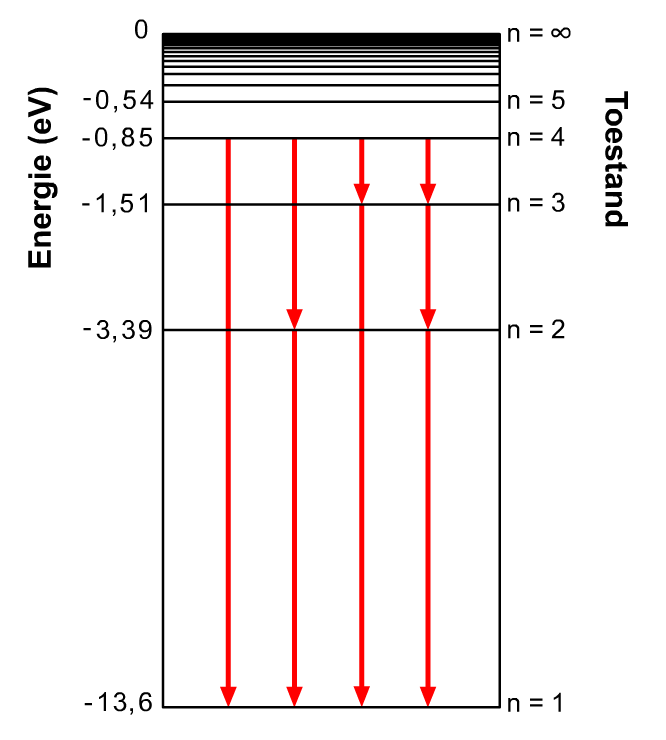
$$E_f = \Delta E \;\;\;\;\;\;\;\; E_f = \frac{-13,6}{3^2} - \frac{-13,6}{2^2} = 1.9 \text{ eV}$$Op den duur valt een aangeslagen elektron helemaal terug naar zijn grondtoestand. Soms gebeurt dit in één stap en soms in meerdere stappen. Hieronder zien we bijvoorbeeld de verschillende manieren waarop een elektron in een waterstofatoom van de derde aangeslagen toestand (n = 4) kan terugvallen naar de grondtoestand (n = 1).
De fotonen die vrijkomen als elektronen van een willekeurige aangeslagen toestand naar de eerste aangeslagen toestand (n = 2) vallen, behoren tot de zogenaamde Balmerserie (zie de onderstaande afbeelding).
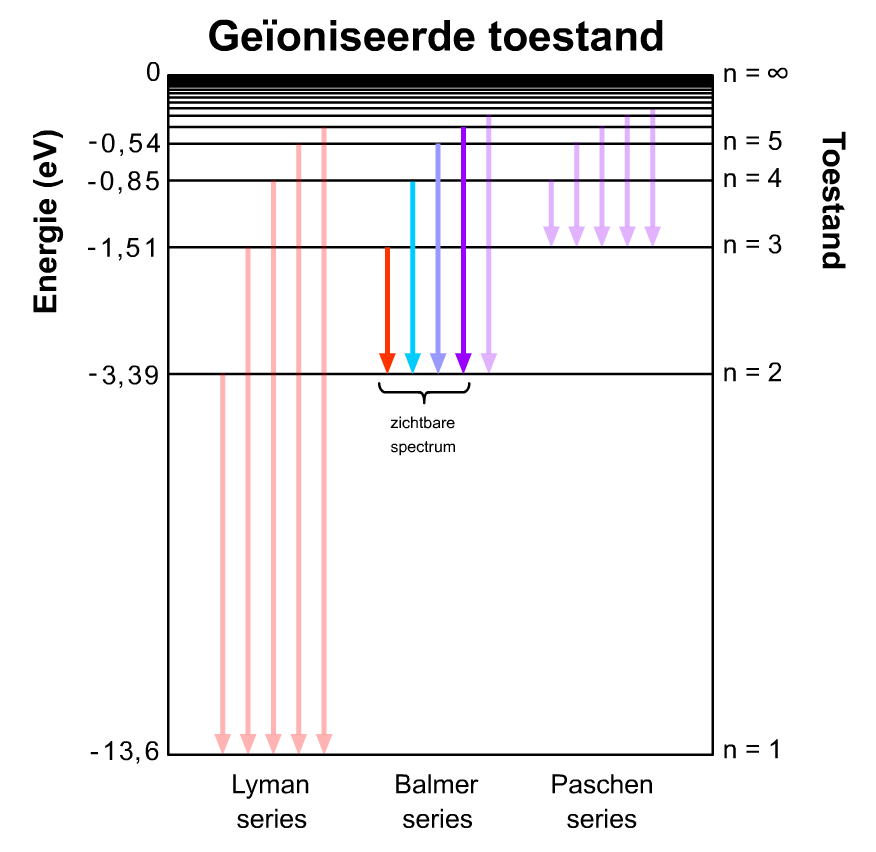
De eerste vier fotonen uit de balmerserie vallen in het zichtbare spectrum. Deze golflengten komen precies overeen met de spectraallijnen van waterstof die we in het hoofdstuk "Astrofysica" hebben gezien. Niels Bohr was hiermee de eerste die de spectraallijnen kon verklaren.

 Demonstratievideo
Demonstratievideo
| ||
|
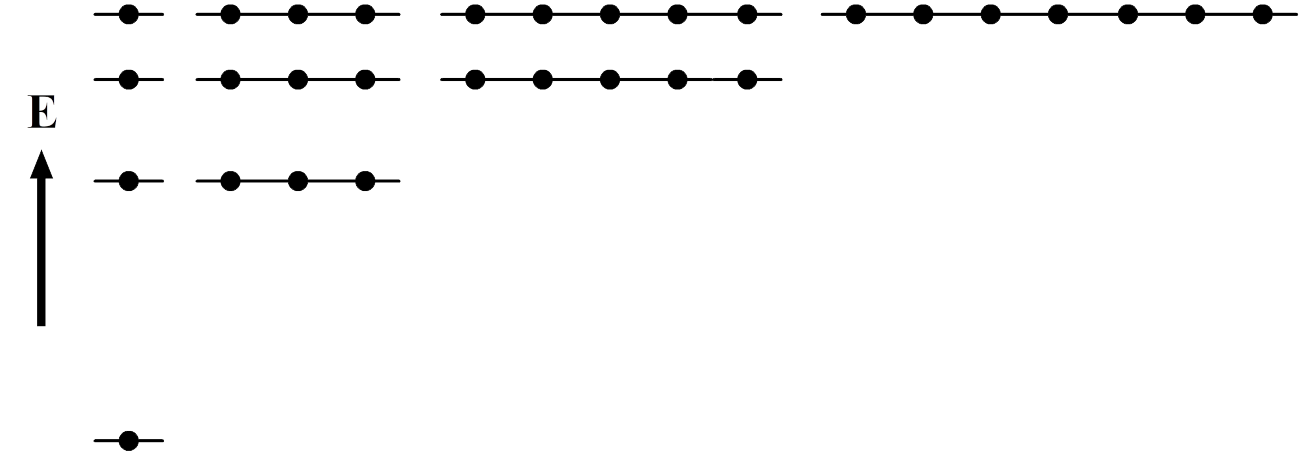
Een nauwkeurigere beschrijving van het waterstofatoom vinden we met behulp van de zogenaamde schrödinger-vergelijking. Deze vergelijking bespreken we in de extra stof op de website. Als je deze vergelijking oplost voor het elektron in een waterstofatoom, dan blijkt dat het elektron zich in de eerste schil slechts in één toestand kan bevinden, in de tweede schil zijn dit er 4, in de derde schil 8, de vierde schil 16, etc. (in de onderstaande afbeelding zijn de verschillende toestanden per energieniveau met punten aangegeven).
Als we de schrödingervergelijking voor complexere atoomsoorten oplossen, dan wordt dit plaatje iets ingewikkelder. Dit komt omdat deze atomen meerdere elektronen hebben die ook elkaar kunnen afstoten. In dat geval vinden we:
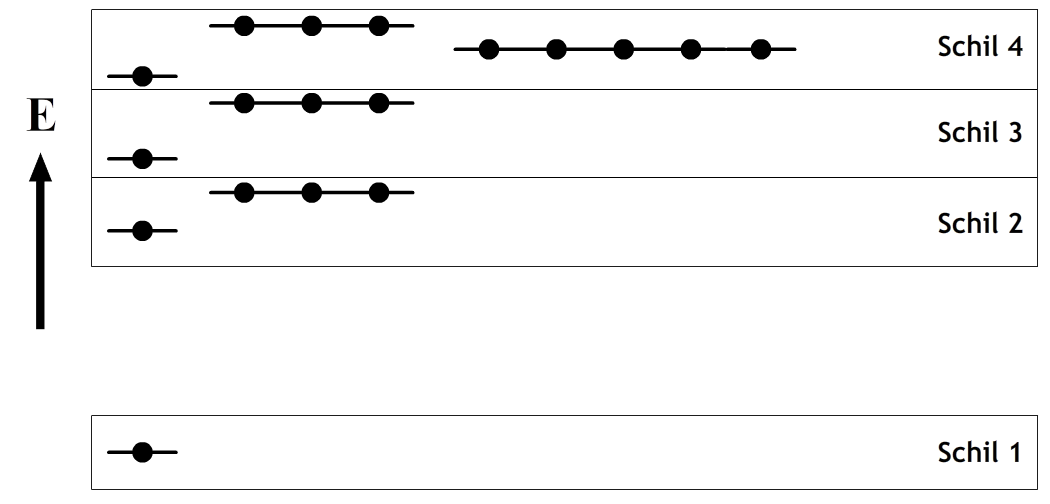
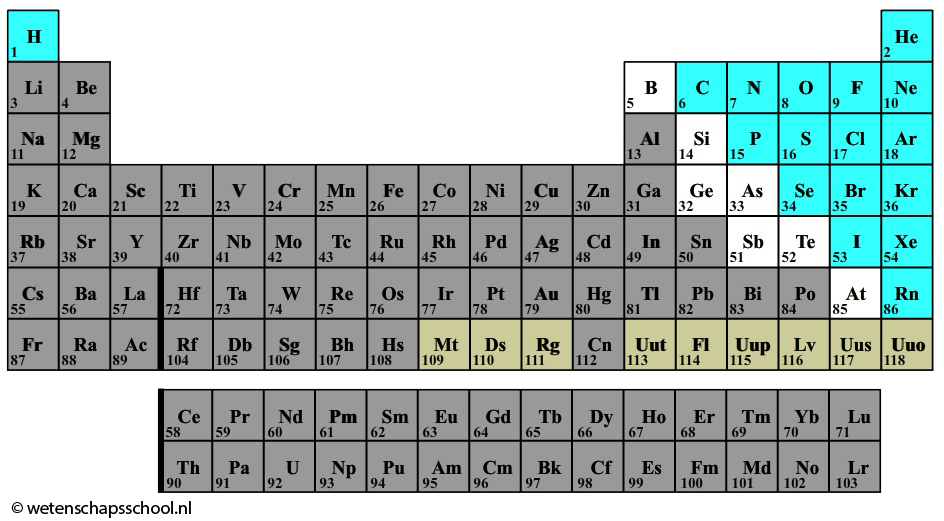
De schillen bevatten nu 1 toestand, 4 toestanden, weer 4 toestanden, 9 toestanden, etc. De wetenschapper Wolfgang Pauli merkte op dat dit rijtje getallen maal twee overeenkomt met het aantal elementen per regel in het periodiek systeem , namelijk 2, 8, 8, 18, etc. (zie de onderstaande afbeelding).
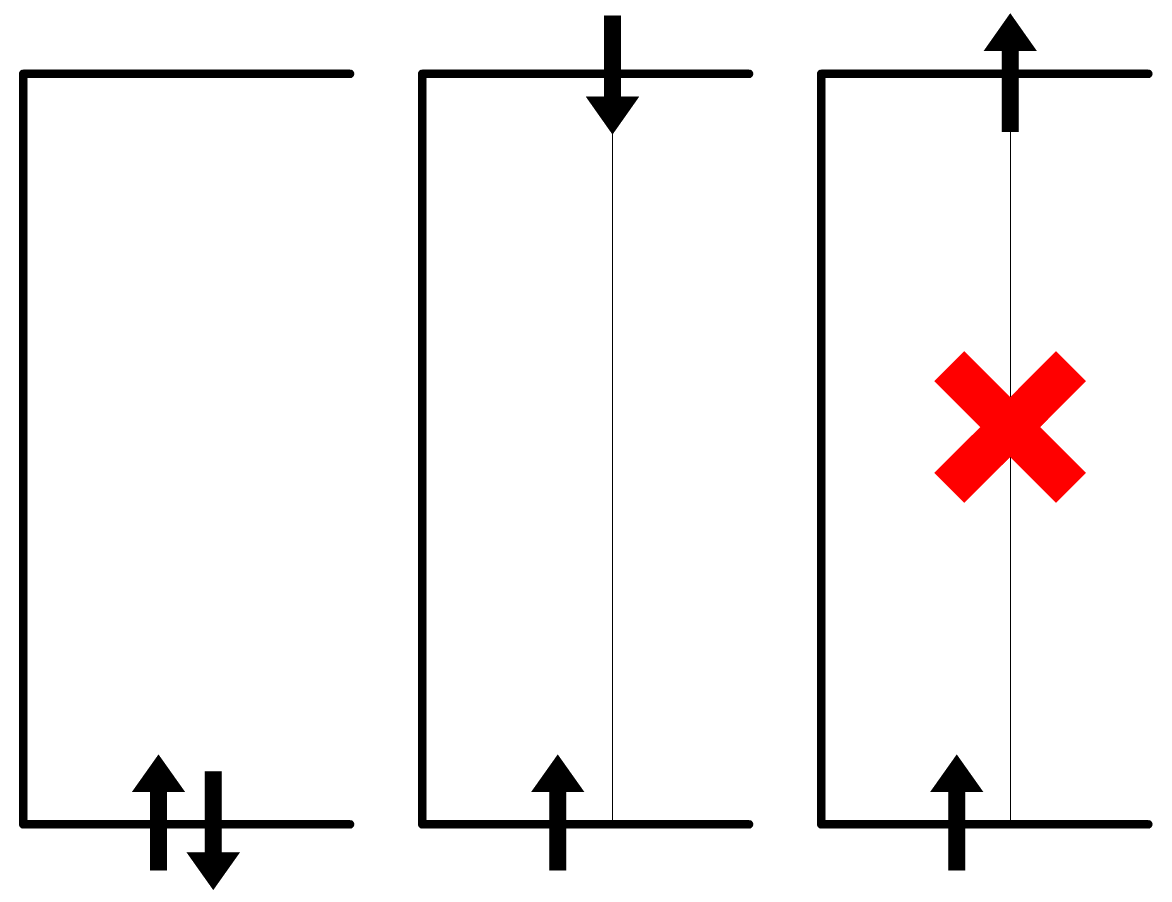
Met behulp van dit inzicht zag Pauli de mogelijkheid om het hele periodiek systeem te verklaren met de kwantummechanica. Hij moest hiervoor de schrödingervergelijking wel op twee manieren repareren. Ten eerste bedacht hij nog een extra toestand genaamd spin. Pauli claimde dat een elektron in elke positie in het energiediagram zowel spin-up (↑) als spin-down (↓) kan hebben. Grofweg kan je de spin opvatten als de draairichting van het elektron. Met de spin erbij verdubbelt het aantal toestanden en komen de schillen netjes overeen met de rijen in het periodiek systeem.
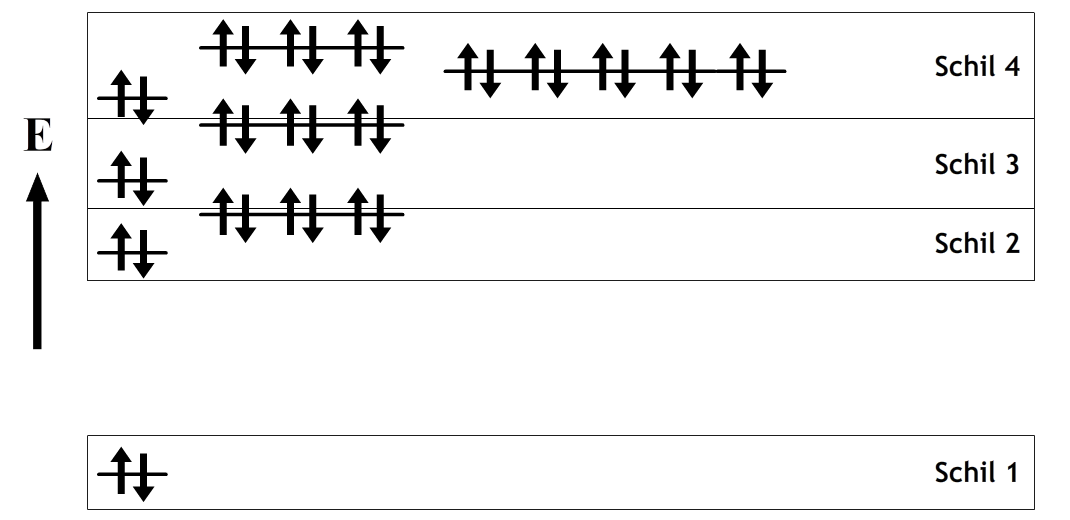
Om dit te laten werken moest Pauli ook aannemen dat elke toestand in een atoom slechts één elektron tegelijk kon bevatten. We noemen dit tegenwoordig het uitsluitingsprincipe van Pauli. Alleen zo kon hij verklaren dat er bijvoorbeeld slechts twee elektronen in de eerste schil passen. Als er een spin-up en een spin-down elektron in de eerste schil zit, dan zit de schil "vol”".
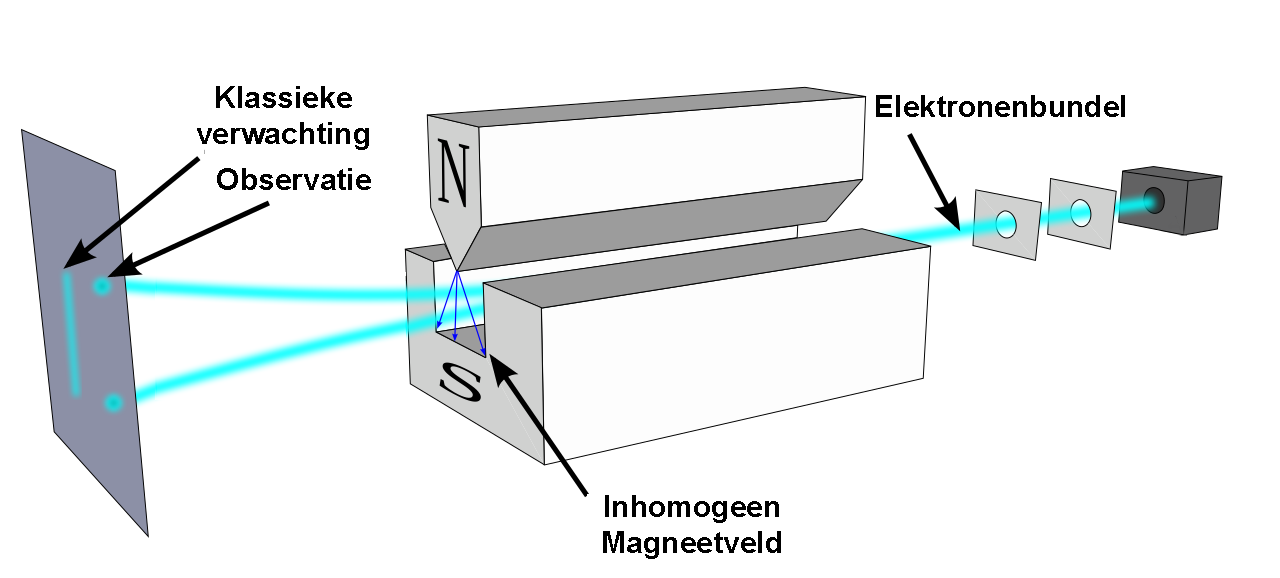
Pauli had geen idee of deze twee spintoestanden daadwerkelijk bestaan, maar niet veel later werd spin daadwerkelijk ontdekt. Dit werd gedaan door Stern en Gerlach, die een bundel elektronen door een inhomogeen magneetveld stuurden. In het magneetveld gedragen de elektronen met spin zich als kleine magneetjes die door het externe veld worden afgebogen. Er werd verwacht dat elektronen aangetroffen zouden worden met alle draairichtingen, maar dit bleek niet het geval. Elektronen hadden alleen spin-up of spin-down, precies zoals Pauli voorspeld had (zie de onderstaande afbeelding).
 Voorbeeld
Voorbeeld
|
|
Vraag: Antwoord:
|
Later werd ook onderzoek gedaan naar de energietoestanden van halfgeleiders. Over het algemeen geldt bij vaste stoffen dat de discrete atomaire toestanden combineren tot vrijwel continue energiebanden, zodat het lijkt alsof de elektronen hier alle energiewaarden kunnen aannemen. In het geval van halfgeleiders combineren de toestanden tot twee continue banden bevinden met tussen die banden een “lege energieruimte” waar zich geen toestanden bevinden. We noemen dit de bandgap (zie de onderstaande afbeelding).
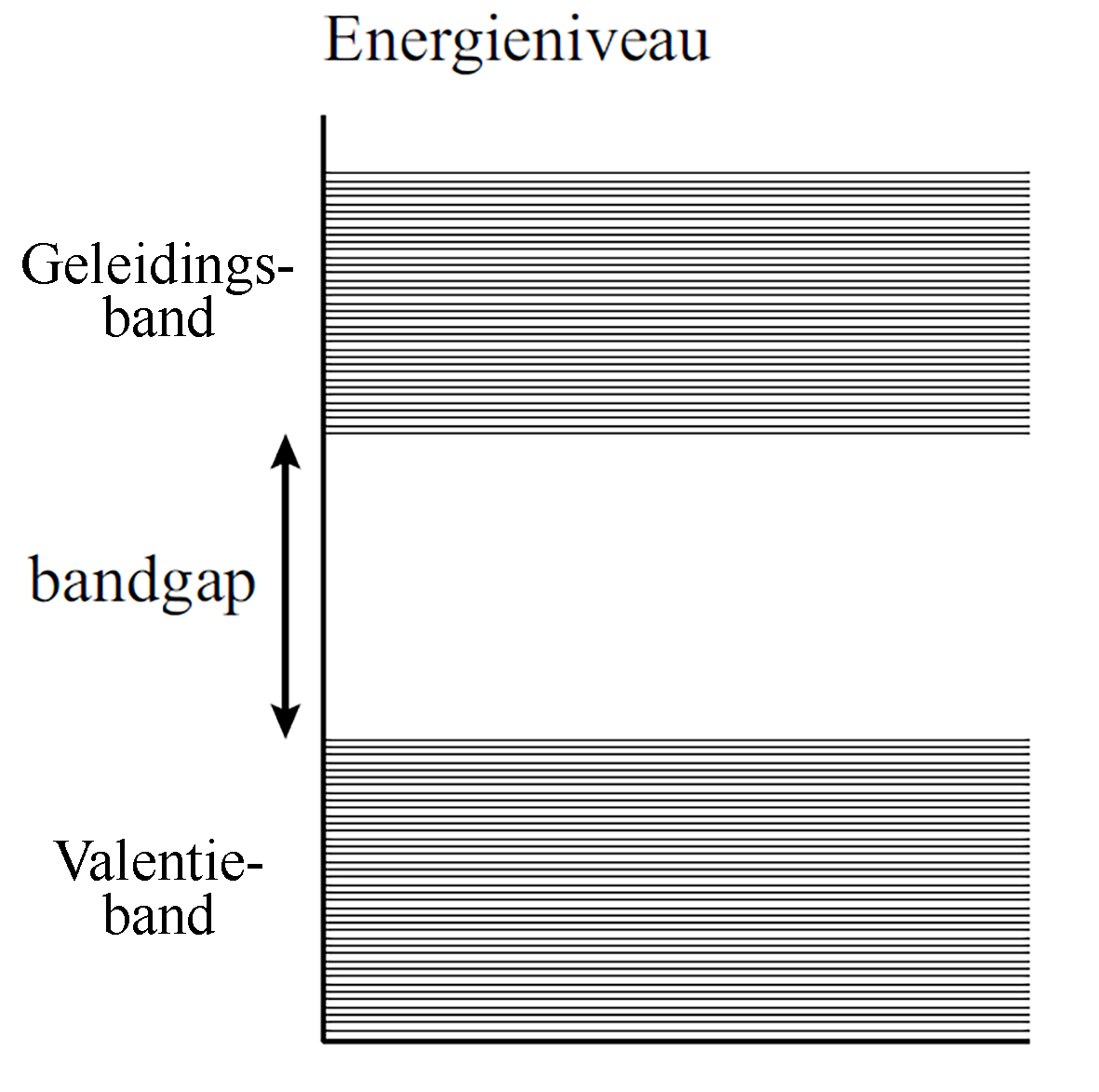
Van deze bandgap wordt goed gebruik gemaakt in bijvoorbeeld zonnecellen. In zijn grondtoestand zitten alle elektronen in het materiaal in de onderste band (ook wel de valentieband genoemd). Als een foton van de zon met genoeg energie op het materiaal valt, dan kan het een elektron naar de bovenste band (de geleidingsband) tillen. Halfgeleiders zijn isolatoren als alle elektronen in de onderste band zitten, maar beginnen te geleiden als er elektronen in de bovenste band zitten. Als gevolg kan er een stroom gaan lopen.
Hetzelfde gebeurt bij een LDR als er licht op valt (zie het hoofdstuk "Elektriciteit"). Als er elektronen in de geleidingsband van de LDR komen, dan neemt hierdoor de weerstand af.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
| ||||||||||||||||||||||||
|
§5 Onzekerheid
DEZE PARAGRAAF VERDWIJNT IN JAAR 2025-2026. EEN DEEL VAN DEZE THEORIE IS GESCHRAPT UIT HET EXAMENPROGRAMMA. DE REST WORDT ONDERDEEL VAN PARAGRAAF 1.
In eerdere paragrafen hebben we gezien dat deeltjes zowel golf- als deeltjeseigenschappen hebben. In deze paragraaf gaan we dit beter begrijpen met behulp van de onzekerheidsrelatie van Heisenberg.
Met de animatie op de website kunnen we golf- en deeltjesverschijnselen beter begrijpen. Met behulp van de onderstaande animatie kunnen we de golf- en deeltjeseigenschappen beter begrijpen. Als je de slider helemaal naar links sleept, dan zien we aan de linkerkant een kwantumgolf met een nauwkeurig te bepalen golflengte, maar de positie van deze golf is onzeker. Het deeltje kan zich overal in de ruimte bevinden (zie de onderste twee afbeeldingen).
Als we de schuif meer naar rechts slepen, dan wordt de positie steeds beter te bepalen, maar nu wordt de golflengte onzeker. Een dergelijke golf is namelijk te maken door heel veel sinussen met verschillende golflengtes bij elkaar op te tellen. In de rechter afbeelding zijn de sinussen zichtbaar die hiervoor gebruikt zijn. We hebben hier dus niet te maken met één golflengte, maar met een hele serie.
Elk deeltje kan door zijn golfeigenschappen dus óf een redelijk te bepalen positie hebben óf een redelijk te bepalen golflengte, maar niet allebei. Omdat de golflengte gerelateerd is aan de impuls via de formule λ = h/p, kunnen we ook zeggen dat niet zowel de positie als de impuls tegelijk nauwkeurig kenbaar kunnen zijn. Dit idee wordt de onzekerheidsrelatie of ook wel de onbepaaldheidsrelatie van Heisenberg genoemd. Meestal wordt dit principe samengevat met behulp van een formule. We gaan deze formule bespreken, maar het is niet nodig hiermee te kunnen rekenen.
$$\Delta x \Delta p \geq \frac{h}{4\pi}$$
|
De "delta's" in deze formule staan voor de onzekerheid. Zoals je in de formule kan zien kan de onzekerheid van de positie en de onzekerheid van de impuls niet nul zijn. Tevens geldt dat als Δx erg klein wordt, dat dan Δp wat groter moet worden en andersom, om zo toch nog aan de vergelijking te kunnen voldoen. Omdat p = mv, betekent een onzekerheid in de impuls ook een onzekerheid in de snelheid. Ook de snelheid van een deeltje kan dus niet geheel kenbaar zijn. Met p = h/λ vinden we dat de onzekerheid in de impuls ook een onzekerheid in de golflengte betekent (hoewel λ hier onder de deelstreep staat, betekent een grotere onzekere impuls natuurlijk niet een zekere λ. Een onzekere impuls levert natuurlijk ook een onzekere λ).
Belangrijk is te realiseren dat deze onzekerheid niet ontstaat omdat onze meetinstrumenten niet goed genoeg zijn, maar omdat deeltjes en golven tegenstrijdige kenmerken hebben die niet tegelijk kunnen bestaan. In het dagelijks leven merken we echter weinig van deze onzekerheid, omdat h erg klein is.
De onzekerheidsrelatie speelt o.a. een grote rol bij elektronen in atomen. Door de kleine massa van een elektron, is de onzekerheid in de impuls vrij klein en als gevolg is de onzekerheid in de positie relatief groot. Als gevolg is de kansgolf van het elektron vaak in dezelfde orde van grootte als het hele atoom. Als we over elektronen in atomen spreken, spreken we daarom vaak van een elektronenwolk. De atoomkern heeft relatief gezien een veel grotere massa en dus ook een grotere onzekerheid in de impuls. Als gevolg kan de onzekerheid in de positie veel kleiner zijn. De atoomkern heeft dus een veel duidelijker gespecificeerde positie.
We kunnen met de onzekerheidsrelatie ook begrijpen waarom elektronen nooit in de atoomkern vallen, terwijl ze wel elektrisch aangetrokken worden tot de kern. Als het elektron namelijk in de kern zou vallen, dan zou het een veel beter gedefinieerde positie hebben en dus een slecht gedefinieerde snelheid. Met zoveel variatie aan snelheid verspreidt het elektron zich weer direct tot een wolk.
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
§6 Tunneling
Deeltjes in de kwantumfysica hebben nog een andere merkwaardige eigenschap. Ze kunnen door barrières heen dringen, waar ze volgens de wet van behoud van energie nooit doorheen zouden moeten kunnen komen. Dit proces wordt tunneling genoemd.
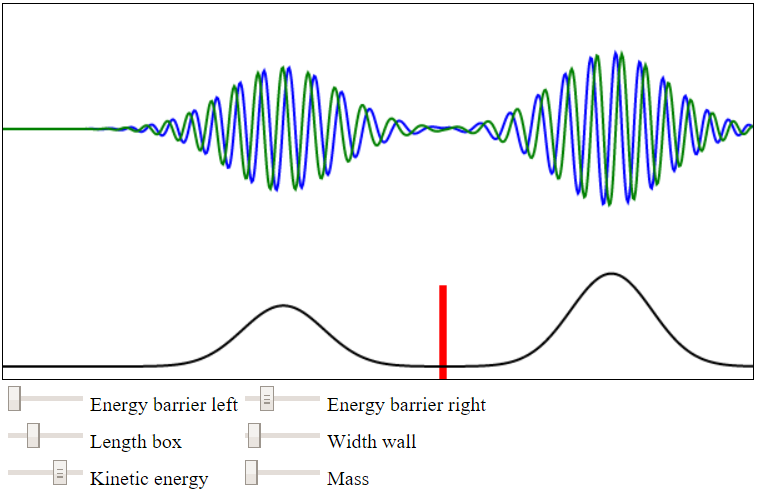
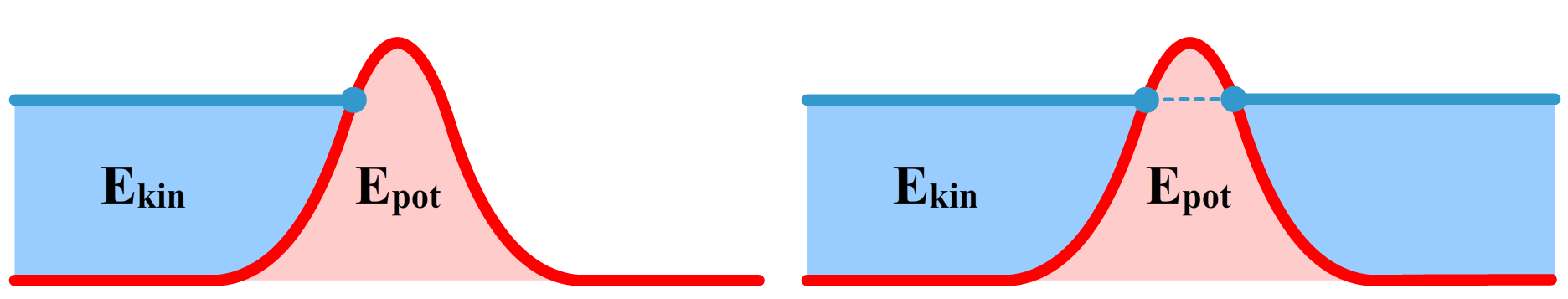
Stel dat we in de klassieke natuurkunde een deeltje over een heuvel willen rollen met een bepaalde beginsnelheid. Volgens de mechanica van Newton zal de bal alleen over de heuvel gaan als de kinetische energie gelijk of groter is dan de zwaarte-energie die de bal op de top zal hebben (we verwaarlozen de wrijvingskrachten). Als de kinetische energie niet voldoende is, dan zal de bal weer terugrollen voordat het de top bereikt. Deze situatie is linksonder geschetst. In de kwantumfysica bestaat er echter een kleine kans dat het deeltje toch door de barrière heen gaat. Dit is in de rechter afbeelding weergegeven. Dit effect wordt tunneling genoemd. Op macroscopisch niveau zien we tunneling eigenlijk zo goed als nooit gebeuren. Als de grootte van de golf echter in de buurt begint te komen van de grootte van de barrière, dan begint dit effect merkbaar te worden. Daarnaast neemt de kans op tunneling ook toe als de massa van het deeltje kleiner is en als het energieverschil tussen het deeltje en de barrière kleiner is
In het onderstaande programma kan je al deze eigenschappen aanpassen en kan je zien wat het effect is op tunneling.
Tunneling is te begrijpen met behulp van de onzekerheidsrelatie. Dankzij de onzekerheid in de golflengte van deeltjes geldt volgens "λ = h/p" dat de impuls ook onzeker is. Volgens "Ekin = p2/(2m)" maakt dit de kinetische energie ook onzeker. Deze onzekerheid zorgt ervoor dat tijdelijk even geen rekening gehouden hoeft te worden met behoud van energie—net lang genoeg om toch over de barrière te komen.
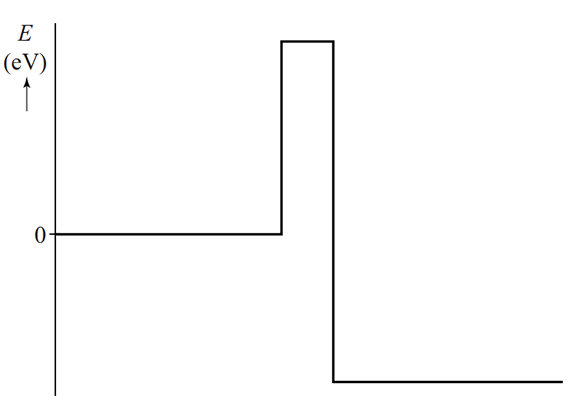
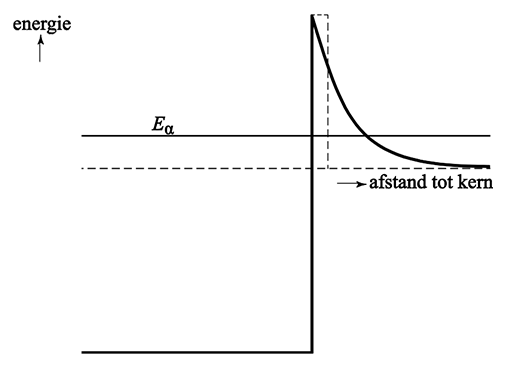
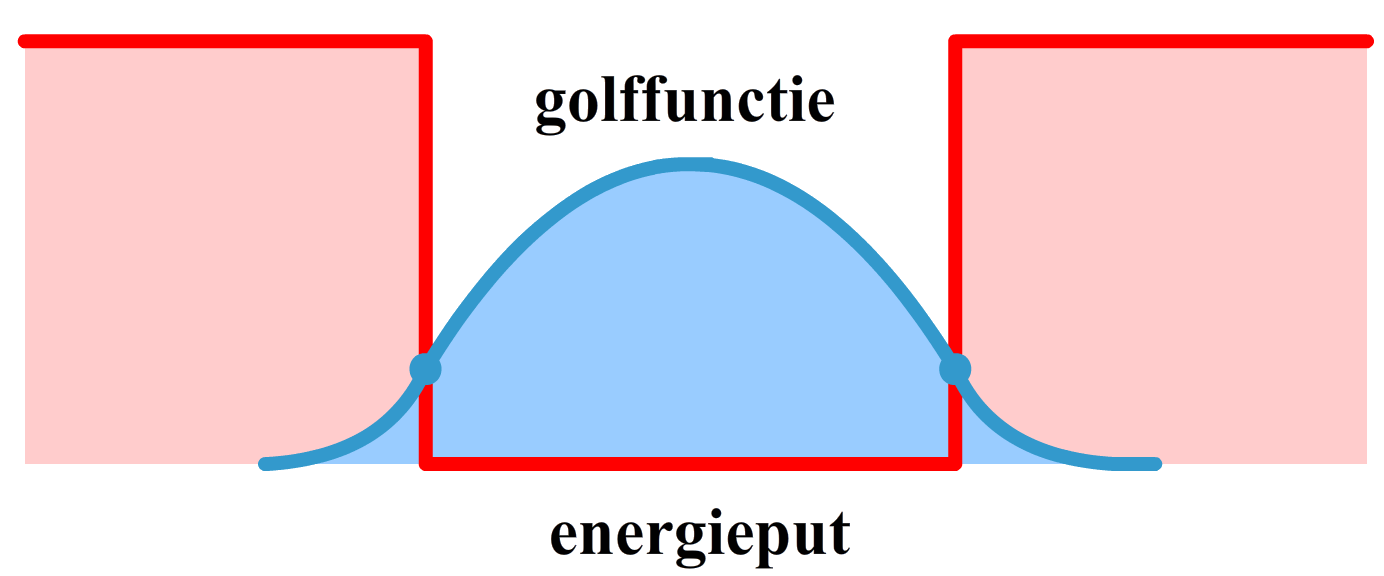
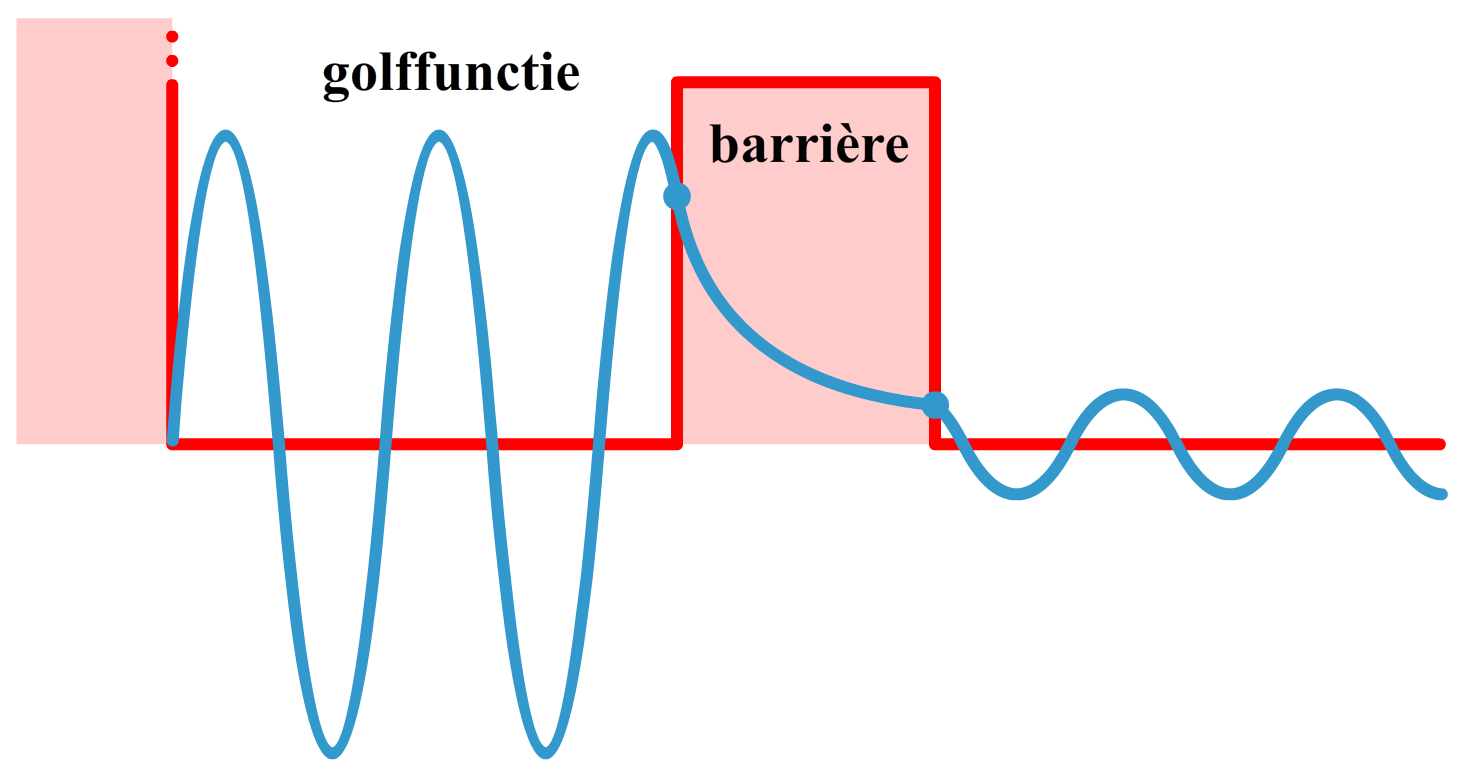
Hieronder zien we de golffunctie van een deeltje in een doosje. Aan de linkerzijde komt het deeltje een muur van oneindig potentiële energie tegen. Hier kan het deeltje dus nooit doorheen. Rechts zien we een barrière met een eindige hoeveelheid energie. Hier kan het deeltje wel doorheen tunnelen. Als je de schrödingervergelijking oplost voor deze situatie, dan vinden we dat de golffunctie in het doosje een sinusachtige vorm heeft. In de barrière neemt de golffunctie exponentieel af en aan de andere zijde van de barrière krijgt de golffunctie weer een sinusachtige vorm. Door de snelle afname in de barrière lekt maar een klein deel van de golffunctie door de barrière weg. Hoe dikker de barrière is, hoe minder van de golffunctie er doorheen komt. Als we nu het deeltje gaan zoeken, dan vinden we hem óf links óf rechts van de barrière. Zoals altijd hangt de kans dat je het deeltje ergens aantreft af van het oppervlak onder de kansverdeling (het kwadraat van de golffunctie). Stel dat we het deeltje rechts vinden, dan is het volledige deeltje, inclusief al zijn energie, aan de rechterkant van de barrière verschenen.
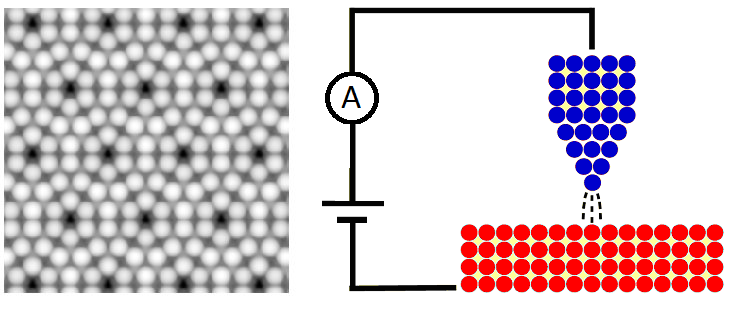
Een ander voorbeeld van een barrière is de elektrische barrière die een elektron ervaart in een atoom door de aantrekkingskracht van de protonen in de kern. Als we een elektron willen laten ontsnappen, dan moet de kinetische energie van dit elektron normaalgesproken groter of gelijk zijn aan de elektrische energie. In de kwantummechanica heeft het elektron echter ook een kleine kans om uit het atoom te tunnelen als er niet voldoende energie is. Hier wordt o.a. gebruik van gemaakt bij de scanning tunneling microscoop (STM). De microscoop bestaat uit een positief geladen dunne naald die over een aantal atomen beweegt. Hoe dichter de naald bij een atoom komt, hoe sterker de elektrische kracht is tussen de naald en de elektronen in deze atomen. Dit verlaagt de elektrisch barrière tussen de naald en het atoom, waardoor de kans groter wordt dat het elektron naar de naald tunnelt. Deze tunnelende elektronen zorgen voor een meetbaar stroompje. Hoe groter deze stroom is, hoe dichter het atoom zich bij de naald bevindt. Door de naald over de atomen te trekken, kan op basis van de gemeten stroomsterkte een beeld worden gemaakt van de atomen.
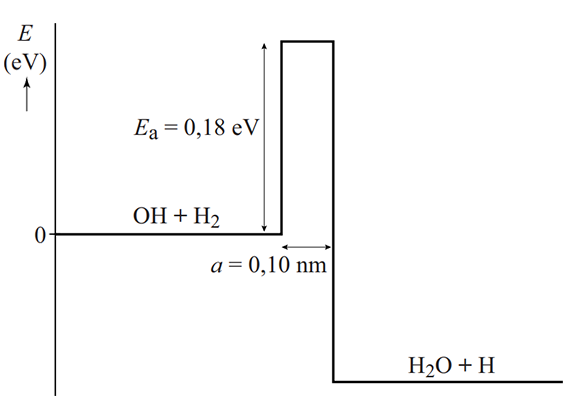
Een ander voorbeeld van tunneling is alfastraling. Bij dit proces tunnelt een heliumkern (twee protonen en twee neutronen) uit een atoomkern. De deeltjes in de kern worden normaalgesproken goed bij elkaar gehouden door de zogenaamde kernkracht. In de kwantummechanica hebben deze deeltjes echter een kans door deze kernkracht-barrière heen te tunnelen. Hieronder zien we de bijbehorende energiediagrammen van dit proces. In de linker afbeelding heeft het deeltje niet genoeg energie om door de barrière heen te kunnen (zelfs niet met tunneling). In het middelste voorbeeld wel. In het rechter voorbeeld gaat het tunnelen nog een stuk gemakkelijker. Niet alleen heeft het deeltje hier meer energie, maar ook de barrière is hier dunner.
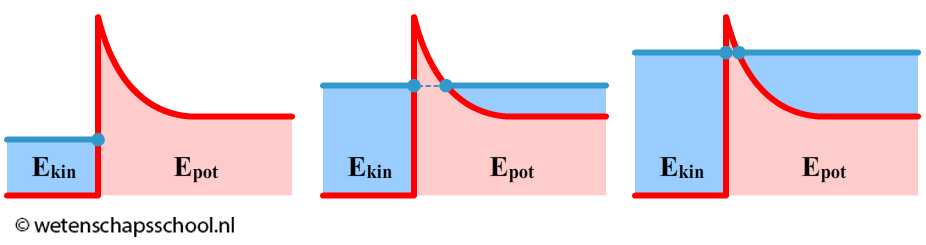
Merk hier ook op dat na het tunnelen een deel van de kinetische energie van het deeltje is omgezet in potentiële energie. De kinetische energie is dus afgenomen en dankzij "Ekin = p2/(2m)" betekent dit ook dat de impuls is afgenomen. Volgens "λ = h/p" betekent dit dat de golflengte is toegenomen. Het deeltje krijg buiten de atoomkern dus een grotere golflengte.
Ook bij kernfusie speelt tunneling een grote rol. In het binnenste van de zon worden waterstofatomen gefuseerd tot heliumatomen. De protonen in beide waterstofatomen moeten hiervoor enorm dicht bij elkaar gedrukt worden. Hier is veel kracht voor nodig, omdat protonen elkaar elektrisch afstoten. Volgens de newtoniaanse mechanica zou zelfs in het centrum van de zon de kracht niet groot genoeg zijn om dit voor elkaar te krijgen. Toch kan fusie plaatsvinden, omdat de protonen af en toe wel door tunneling samenkomen. Bij deze fusie komt het zonlicht vrij dat wij dagelijks waarnemen. Zonder tunneling zou de zon dus geen licht geven!
 Leerdoelen:
Leerdoelen:
|
|
 Opdrachten
Opdrachten
|
|
| BINAS: | |
| 5 | Elektronvolt |
| 7 | Constante van Planck, elektronlading, lichtsnelheid en massa elektron |
| 21 | Energieniveaus waterstof |
| 24 | Foto-elektrisch effect (uittree-energie, grensfrequentie en grensgolflengte) |