De kwantumfysica geeft ons een zeer nauwkeurige beschrijving van de kleine deeltjes waaruit de wereld bestaat. De eerste doorbraak in deze theorie was Einstein’s ontdekking dat licht uit deeltjes bestaat. Deze deeltjes worden fotonen genoemd. In deze paragraaf gaan we lezen hoe deze ontdekking gedaan is.
Als we licht op metaalatomen schijnen, dan kan dit licht geabsorbeerd worden door de elektronen in deze atomen. In sommige gevallen heeft het licht genoeg energie om elektronen uit de atomen trekken. De elektronen schieten dan weg van de metaalatomen. Dit wordt het foto-elektrisch effect genoemd.
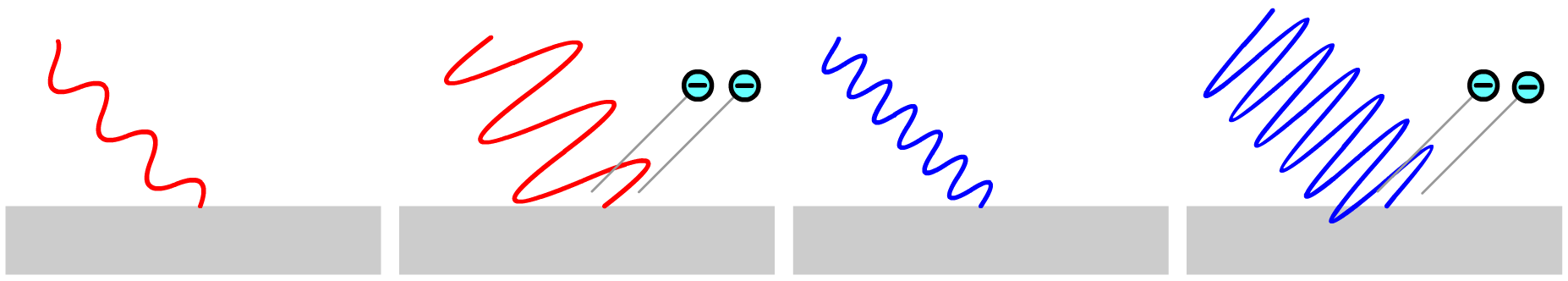
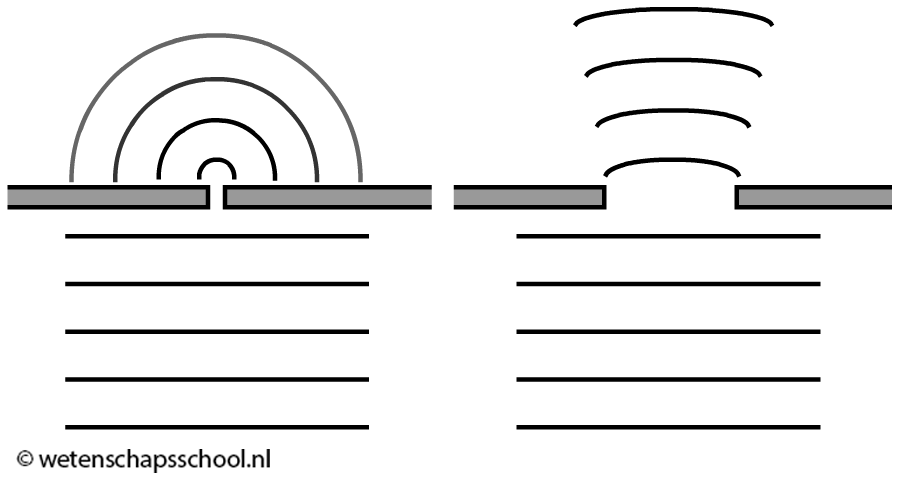
In de 19de eeuw werd ontdekt dat licht golfeigenschappen heeft. Als gevolg werd gedacht dat het ontsnappen van de elektronen zou moeten afhangen van de intensiteit (en dus van de amplitude) van deze golven. Volgens deze theorie zou elke kleur licht elektronen moeten kunnen laten ontsnappen uit het metaal, als we het licht maar fel genoeg maken (zie de onderstaande afbeelding).

In werkelijkheid bleek dit echter niet het geval. In plaats van de intensiteit, bleek het de frequentie (en dus de kleur) van het licht het verschil te maken. Als de frequentie boven een bepaalde grensfrequentie (fgrens) komt, dan ontsnappen de elektronen en anders niet. In BINAS vinden we voor verschillende stoffen deze grensfrequentie. Licht dat deze grensfrequentie niet bereikt, zal nooit elektronen doen laten ontsnappen, hoe fel we het licht ook maken.
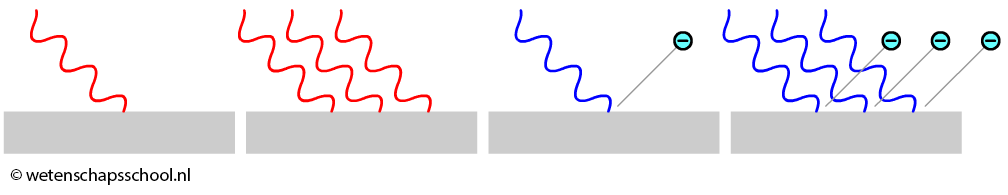
Einstein concludeerde op basis van deze observatie dat licht behalve golf- ook deeltjeseigenschappen heeft. Volgens Einstein was licht opgebouwd uit kleine deeltjes genaamd fotonen. Als de lichtgolf het metaal raakt, dan is het niet de gehele golf die geabsorbeerd wordt, maar de individuele fotonen waaruit het licht bestaat. Als een enkel foton genoeg energie heeft, dan zal het elektron ontsnappen uit het atoom en anders niet. De intensiteit heeft hier geen invloed op. Hoe hoger de intensiteit, hoe meer fotonen, maar als elk afzonderlijk foton niet genoeg energie heeft, dan zal geen van deze fotonen in staat zijn een elektron te laten ontsnappen.
Max Planck had eerder in een onderzoek aangetoond dat de energie van een foton gelijk is aan:
$$E_{foton} = hf$$
|
Met de formule v = fλ uit het hoofdstuk trillingen en golven, kunnen we deze formule herschrijven. Als we voor de snelheid v de lichtsnelheid c gebruiken, dan vinden we:
$$E_f = h\frac{c}{\lambda}$$
|
Naast de grensfrequentie bestaat ook de grensgolflengte. Voor een aantal metalen zijn ook deze waarden in BINAS te vinden. Met behulp van de bovenstaande formule kunnen we zien dat een grotere golflengte zorgt voor een kleinere energie. Alleen bij golflengtes kleiner dan de grensgolflengte vindt dus het foto-elektrisch effect plaats.
De energie van fotonen wordt in plaats van joule ook wel in elektronvolt (eV) gegeven. Er geldt:
|
$$1 \text{ eV} = 1,6022 \times 10^{-19} \text{ J}$$
|
Bij het foto-elektrisch effect moet het foton in ieder geval genoeg energie hebben om het elektron uit het metaal te trekken. Deze energie wordt de uittree-energie (Euittree) of ook wel de ionisatie-energie genoemd. De uittree-energie is voor verschillende stoffen in BINAS te vinden. Als er dan nog energie over is, dan wordt deze energie meegegeven aan het elektron in de vorm van kinetische energie. Dit is de energie waarmee het elektron wegschiet uit het materiaal. Er geldt dus:
|
$$E_{foton} = E_{uittree} + E_{kin} \;\;\; \text{(bij ontsnappen elektron)}$$
|
Met de onderstaande schakeling kunnen we het foto-elektrisch effect nauwkeuriger bestuderen. Een metalen plaatje (aangegeven met de rode streep) wordt aangesloten op de minpool van een spanningsbron. Een metalen bolletje (het rode stipje) wordt aangesloten op de pluspool. In eerste instantie wordt de spanning op 0 volt gezet. Als we licht op het metalen plaatje schijnen, dan komen er elektronen vrij. Een aantal van de elektronen zal toevallig tegen het metalen bolletje aan de overkant komen (zie afbeelding A). Op deze manier ontstaat een stroom van elektronen die met de ampèremeter kan worden gemeten.
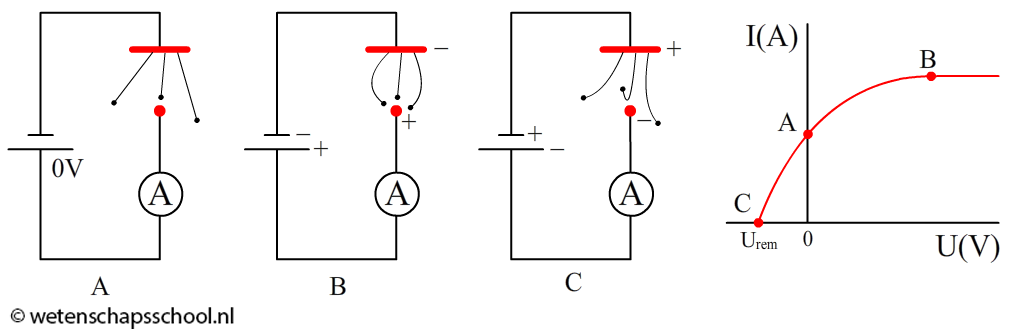
Als we de spanning groter maken dan 0 V, dan wordt het metalen bolletje positief (zie afbeelding B). Dit zorgt ervoor dat de losvliegende elektronen tot het bolletje worden aangetrokken. Er zullen hierdoor meer elektronen aankomen, waardoor de stroomsterkte toeneemt. Als we de spanning blijven verhogen, dan komt er een moment dat alle losgekomen elektronen op het metalen bolletje terecht komen. De stroomsterkte is nu maximaal. Als we de spanning nog hoger zetten, dan zal de stroomsterkte nu niet meer toenemen, omdat alle losgekomen elektronen immers al zijn aangekomen.
We kunnen de spanning ook negatief maken. In dat geval wordt het metalen bolletje negatief. De elektronen die vrijkomen worden hier nu juist door afgestoten (zie afbeelding C). Bij een bepaalde negatieve spanning komt geen enkel elektron meer aan. De stroomsterkte is dan 0 A. De spanning waarbij dit voor het eerst gebeurt, noemen we de remspanning (Urem). Hoe groter de kinetische energie van de elektronen is, hoe groter de remspanning moet zijn om de elektronen af te remmen. Bij het afremmen wordt de kinetische energie geheel omgezet in elektrische energie.
$$ E_{kin} = E_{elek} $$De formule voor de elektrische energie van een geladen deeltje is:
$$E_{elek} = qU$$
|
Voor het elektron is de lading (q) gelijk aan de elektronlading (e). De lading is te vinden in BINAS.
Met de bovenstaande formules wordt de energieomzetting van het foto-elektrisch effect:
$$E_{foton} = E_{uittree} + E_{kin}$$ $$hf_{foton} = hf_{grens} + eU_{rem}$$Met deze formule kunnen we de constante van Planck en de grensfrequentie van verschillende metalen bepalen.
 Redeneren en rekenen met het foto-elektrisch effect
Redeneren en rekenen met het foto-elektrisch effect
|
|
In de vorige paragraaf hebben we gezien dat licht uit deeltjes bestaat genaamd fotonen. In deze paragraaf gaan we zien dat licht ook golfeigenschappen heeft. Tevens gaan we zien dat ook massieve deeltjes zoals elektronen zowel golf- als deeltjesverschijnselen hebben.
We kunnen als volgt aantonen dat licht ook golfeigenschappen heeft. Als we licht op een plaatje met twee dunne spleetjes schijnen, dan ontstaan achter beide spleet cirkelvormige golven, die met elkaar gaan interfereren (zie de onderstaande afbeelding). We noemen dit het dubbele spleet experiment. Als we achter het scherm een detector plaatsen, dan zien we op dit scherm maxima en minima zoals we dat ook in het hoofdstuk over geluid gezien hebben.
Als licht alleen deeltjeseigenschappen zou hebben, dan hadden we het onderstaande patroon gezien. Licht zou dan slechts op twee plekken op het scherm te zien zijn. Dit is echter niet het geval. Licht gedraagt zich dus duidelijk als een golf in dit experiment. Omdat licht dus zowel deeltjes- als golfeigenschappen heeft, spreken we hier van golf-deeltje-dualiteit.

Later ontdekte men dat deze dualiteit niet alleen geldt voor fotonen, maar voor alle elementaire deeltjes. We kunnen bijvoorbeeld ook elektronen door twee spleten schieten. In de onderstaande afbeelding zien we wat er in dat geval gebeurt. Ten eerste zien we dat de elektronen op specifieke punten op de detector terecht komen. Dit suggereert dat elektronen deeltjes zijn. Maar als we lang genoeg wachten, dan zien we een interferentiepatroon ontstaan. Dit suggereert juist dat elektronen golven zijn. Een dergelijk interferentiepatroon kan alleen ontstaan als elk elektron door beide spleten is gegaan en met zichzelf heeft geinterfereerd! Het moment dat de elektrongolf echter tegen de detector botst, verschijnt het elektron als een puntje op het scherm, alsof het juist een deeltje is! De golf is op dat moment dus ineengeklapt tot een deeltje. Dit lijkt onlogisch, maar toch is dit wat we meten. De bekende kwantumfysicus Niels Bohr zei over deze vreemde effecten: 'wie zegt de kwantumfysica te begrijpen, heeft het niet begrepen'.

Maar wat bepaalt dan waar het elektron terecht komt op de detector? Dit blijkt niet te voorspellen te zijn. Het is niet mogelijk van te voren uit te vinden waar het elektron op het scherm zal komen. Het enige dat we weten, is dat als je genoeg elektronen afschiet, dat dan een voorspelbaar interferentiepatroon ontstaat. Bij de maxima is de kans op een elektron het grootst en bij de minima is er geen kans het elektron te vinden. De kwantumfysica is dus gebaseerd op kans en het interferentiepatroon geeft ons hoe groot deze kans is. We noemen dit patroon daarom ook wel een waarschijnlijkheidsverdeling (P). Hieronder zien we een afbeelding van de waarschijnlijkheidsverdeling die bij dit experiment hoort:
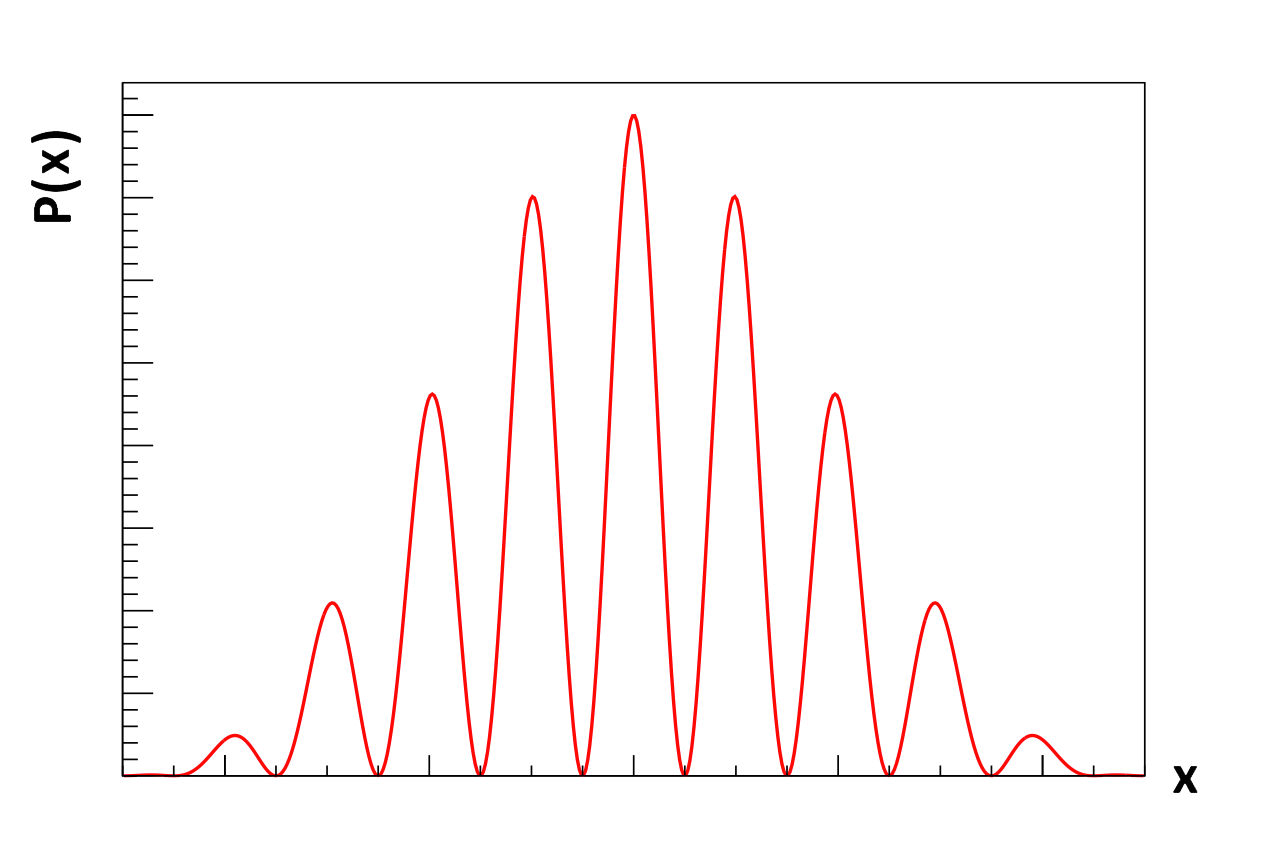
Als je de kans wil vinden dat je een elektron in een bepaald gebiedje zal aantreffen, dan doe je dat door de oppervlakte onder de grafiek te bepalen. Het totale oppervlak onder de grafiek is dus altijd 1, oftewel 100%. Als je overal zoekt, heb je namelijk zekerheid dat je het elektron ergens zal vinden.
Als een elektron dus een golf is, dan moet het ook een golflengte hebben. De wetenschapper Louis de Broglie vond één formule voor de golflengte van alle deeltjes. We noemen dit de debroglie-golflengte. Er geldt:
$$\lambda = \frac{h}{p}$$
|
De impuls wordt voor deeltjes met massa gegeven door:
$$p = mv$$
|
Omdat de impuls zo vaak gebruikt wordt in de kwantummechanica, gaan we formule voor de kinetische energie als volgt omschrijven:
$$E_{kin}= \frac{1}{2}mv^2$$ $$E_{kin}= \frac{m^2v^2}{2m}$$ $$E_{kin} = \frac{p^2}{2m}$$
$$E_{kin} = \frac{p^2}{2m}$$
|
In het dagelijks leven merken we weinig van de golfeigenschappen van deeltjes. Dit komt omdat de constante van Planck (h) in de formule van de Broglie erg klein is. Aan de formule λ = h/p zien we dat de golflengte alleen groot wordt als de impuls (p) erg klein is. Dit gebeurt bijvoorbeeld als we een stof extreem koud maken. In dat geval wordt de snelheid en dus ook de impuls van de deeltjes klein.
De formule van de Broglie speelt o.a. een rol in de microscopie. Om dit te begrijpen moeten we eerst het begrip buiging begrijpen. Golven buigen namelijk om voorwerpen heen. Bij geluid kennen we dit effect allemaal. We kunnen bijvoorbeeld iemand horen die om een hoek staat, omdat het geluid de hoek om buigt.
Hieronder zien we golven die zich door een dunne en een brede spleet bewegen. Als de spleet klein is ten opzichte van de golflengte, dan treedt veel buiging op. Zo niet, dan treedt juist weinig buiging op. Bij een erg brede spleet vindt bijna helemaal geen buiging plaats. Dankzij de kleine golflengte van zichtbaar licht, merken we weinig van het buigen van licht in het dagelijks leven. Voor radiogolven is dit echter een ander verhaal. Radiogolven hebben een veel grotere golflengte en buigen daarom gemakkelijk om alledaagse voorwerpen heen. Dit is waarom een radio bijna overal ontvangst heeft. Het radiostraling buigt zich om alle voorwerpen heen en komt zo in alle uithoeken terecht.
In de onderstaande afbeelding wordt een voorwerp beschenen met licht. Ook hier treedt buiging op. Als het voorwerp klein is ten opzichte van de golflengte, dan treedt veel buiging op. Zo niet, dan vindt weinig buiging plaats. Links in de afbeelding treedt dus weinig buiging op en als gevolg is er achter het voorwerp een duidelijke schaduw te zien. Rechts is de buiging zo extreem dat de golven hun pad vervolgen alsof er helemaal geen voorwerp aanwezig is.
Dit effect zorgt voor een limiet bij het gebruik van lichtmicroscopen. Als de golflengte van zichtbaar licht groter is dan het voorwerp dat je wilt bekijken, dan krijg je door buiging geen goed beeld. Bij erg kleine voorwerpen moet dus een andere type microscoop gebruikt worden. Een voorbeeld is een elektronenmicroscoop. Stel dat de elektronen in dit type microscoop met een snelheid van 2,3 × 105 m/s worden afgeschoten op het voorwerp dat we willen bekijken, dan vinden we de volgende debroglie-golflengte:
$$\lambda = \frac{h}{mv}$$ $$\frac{6,63\times 10^{-34}}{9,31\times 10^{-31} \times 2,3 \times 10^5}=3,0 \;\text{nm} $$Dit is klein genoeg om bijvoorbeeld een virus te kunnen bekijken, hetgeen met een normale microscoop niet mogelijk is.
 Redeneren met buiging en interferentie
Redeneren met buiging en interferentie
|
|
 Redeneren met de kansverdeling
Redeneren met de kansverdeling
|
|
 Rekenen met de debroglie-golflengte
Rekenen met de debroglie-golflengte
|
|
Om kwantumeffecten beter te begrijpen, bestuderen we in deze paragraaf het simpelste kwantumsysteem: het deeltje in een doos.
In deze paragraaf bestuderen we een deeltje dat alleen naar links en rechts kan bewegen in een afgesloten ruimte (zie de onderstaande afbeelding). We noemen dit het deeltje in een doos.

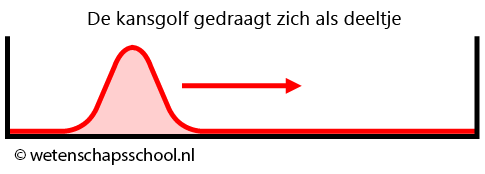
Als de doos groot is ten opzichte van de kansgolf van het deeltje, dan zal de kansgolf zich als een deeltje gedragen. De kansgolf zal dan heen en weer botsen in het doosje alsof het een deeltje is (zie de onderstaande afbeelding).
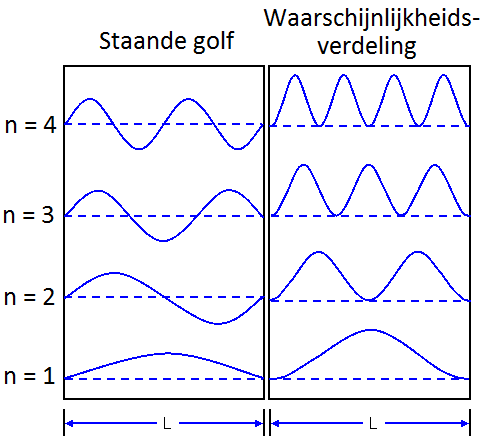
Als de doos echter klein is ten opzichte van de kansgolf, dan beginnen we golfverschijnselen te merken. Als de golf reflecteert tegen de wanden, dan begint deze namelijk met zichzelf te interfereren. Net als bij trillingen in een snaar ontstaat hierbij dan een staande golf met knopen en buiken. Net als bij een snaar geldt dan ook:
$$L = \frac{1}{2}\lambda n \;\;\;\; \text{(twee vaste uiteinden)}$$In het geval van een deeltje in een doos noemen we n = 1 de grondtoestand en n = 2,3,... de aangeslagen toestanden. n = 2 noemen we de eerste aangeslagen toestand. n = 3 noemen we de tweede aangeslagen toestand. Etc. Hieronder zien we een aantal toestanden van een deeltje in het doosje. Hoe groter de amplitude van de kansgolf, hoe meer kans dat je het deeltje daar zal aantreffen.
Als we de formule L = ½ λn combineren met λ = h/p, dan vinden we:
$$p=nh/2L$$Als we deze formule combineren met Ekin = p2/(2m), dan vinden we:
$$E_{kin,n} = \frac{n^2h^2}{8mL^2}$$
|
Een aantal dingen kunnen we aan deze formule opmerken. Ten eerste zien we dat het elektron in het doosje niet zomaar elke kinetische energie (en dus niet elke snelheid) kan aannemen. Alleen de waarden die overeenkomen met de staande golven zijn mogelijk. We zeggen daarom dat de energie gekwantiseerd zijn. Merk ook op dat het niet mogelijk is dat het deeltje geen kinetische energie heeft. Zelfs in de grondtoestand n = 1, de laagste toestand, heeft het deeltje namelijk volgens de formule nog gewoon energie. We noemen dit de nulpuntsenergie. Een deeltje in een doos kan dus niet stilstaan!
Als de lengte L van de doos groot wordt, dan kan je aan de formule zien dat de energieniveaus erg dicht op elkaar komen te liggen. Op een gegeven moment komen deze niveaus zo dicht bij elkaar te liggen dat het lijkt alsof het deeltjes gewoon alle energieniveaus kunnen aannemen. Dit is waarom we in het dagelijks leven niks merken van de kwantisering.
Een deeltje in een doosje kan naar een hoger energieniveau springen door o.a. een foton te absorberen met een energie die precies overeenkomt met het verschil tussen het huidige energieniveau en een hoger niveau. Er geldt dus:
$$E_{foton} = \Delta E_n$$
|
Dezelfde formule geldt als een elektron terugvalt naar een lager niveau. In dat geval komt er juist een foton vrij. Stel dat een elektron in een doosje met een lengte van 2,0 nm bijvoorbeeld terugvalt van de eerste aangeslagen toestand naar de grondtoestand. Er geldt dan:
$$E_{foton} = \frac{2^2h^2}{8mL^2} - \frac{1^2h^2}{8mL^2}$$ $$E_{foton} = \frac{3h^2}{8mL^2}$$ $$E_{foton} = \frac{3 \times (6,6 \times 10^{-34})^2}{8 \times 9,1 \times 10^{-31} \times (2,0 \times 10^{-9})^2} = 4,5 \times 10^{-20} \text{ J} = 0,28 \text{ eV}$$
 Rekenen met een deeltje in een doosje
Rekenen met een deeltje in een doosje
|
|
Met de kwantumfysica kunnen we ook het waterstofatoom beschrijven. In deze paragraaf gaan we zien hoe dit werkt.
De kwantummechanische beschrijving van het waterstofatoom wordt ook wel het atoommodel van Bohr genoemd. Net als in het geval van het deeltje in een doos, kan ook het elektron in een waterstofatoom gezien worden als een staande golf. Ook het elektron in waterstof kan zich in de grondtoestand of één van de aangeslagen toestanden bevinden. In elke toestand bevindt het elektron zich in een andere schil om de kern (zie de onderstaande afbeelding).
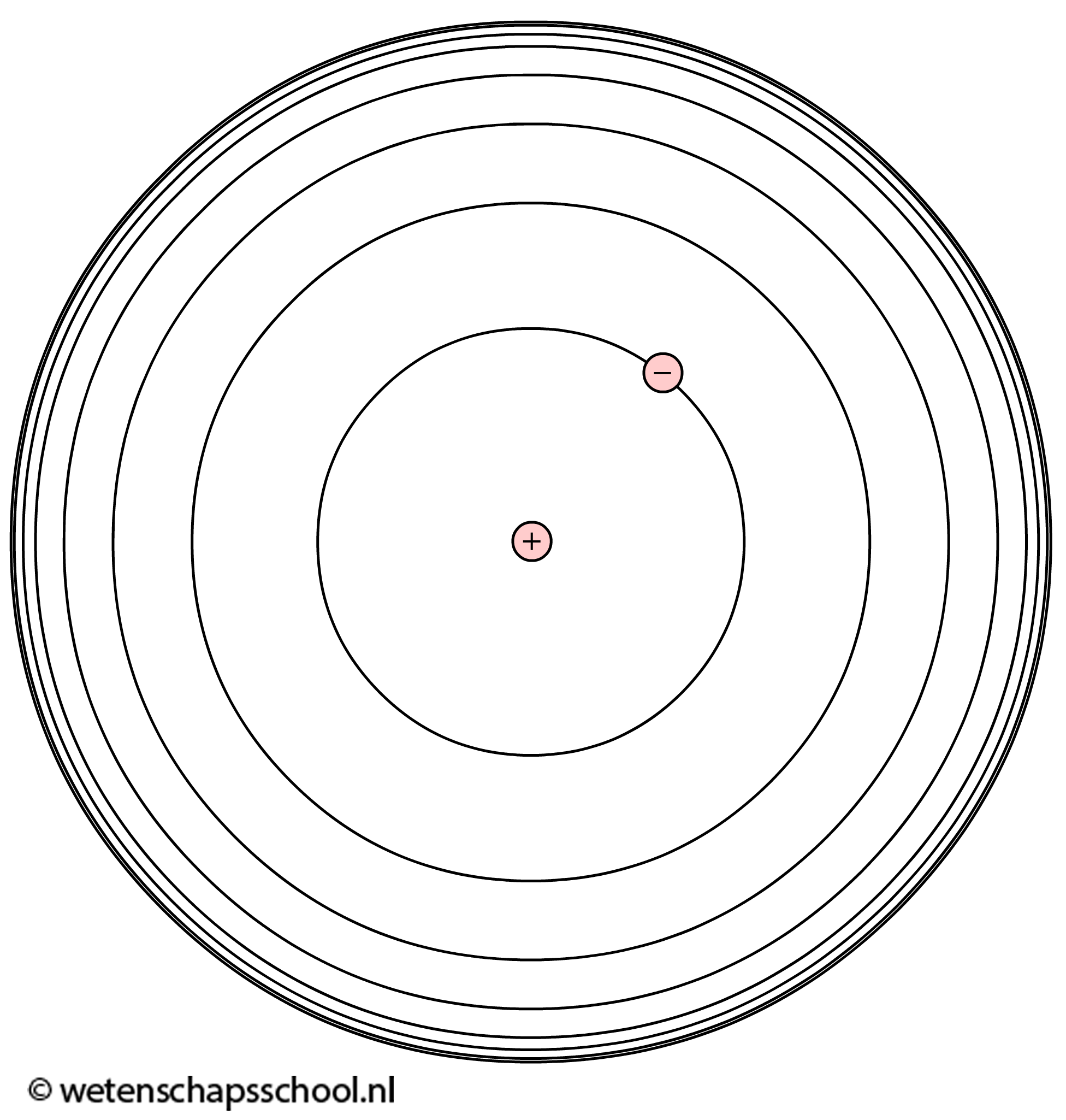
In elke schil heeft het elektron een specifieke energie. Deze energie bestaat uit een combinatie van kinetische en elektrische energie. In een opdracht onder aan deze paragraaf zullen we bewijzen dat de energieniveaus die bij deze toestanden horen gegeven worden door:
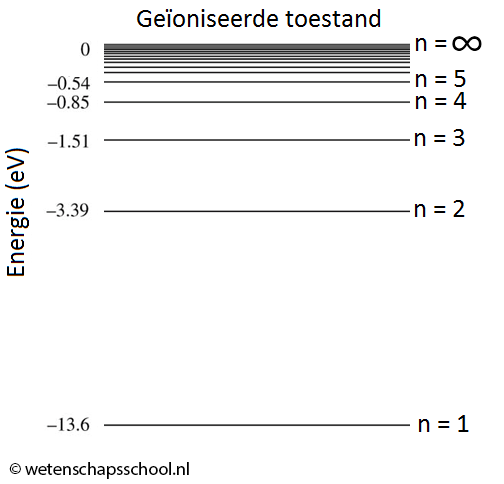
$$E_n(\text{eV}) = \frac{-13,6}{n^2} \;\;\;\; \text{(waterstofatoom, energie in eV)}$$
|
Merk op dat de energie in deze formule in elektronvolt is gegeven.De energieniveaus uit de formule zijn hieronder ook schematisch weergegeven. Deze afbeelding is ook te vinden in BINAS.
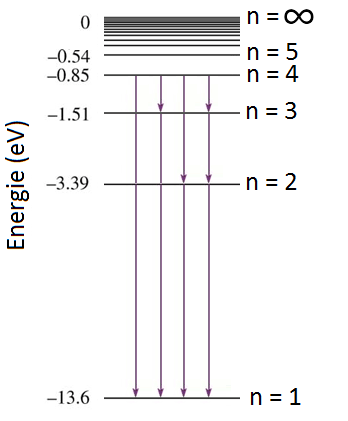
Net als bij het deeltje in het doosje, kan een elektron in waterstof verspringen naar een hoger energieniveau door een foton op te nemen en kan het elektron verspringen naar een lager niveau door dit foton weer uit te zenden. Bij een overgang van n = 3 naar n = 2, komt bijvoorbeeld een foton vrij met de volgende energie:
$$E_f = \Delta E = \frac{-13,6}{2^2} - \frac{-13,6}{3^2} = 4.9 \text{ eV}$$Op den duur valt een aangeslagen elektron helemaal terug naar zijn grondtoestand. Soms gebeurt dit in één stap en soms in meerdere stappen. Hieronder zien we bijvoorbeeld de verschillende manieren waarop een elektron in een waterstofatoom van de derde aangeslagen toestand (n=4) kan terugvallen naar de grondtoestand (n=1).
De fotonen die bij waterstof vrijkomen als elektronen van een willekeurige aangeslagen toestand naar de eerste aangeslagen toestand (n = 2) vallen, behoren tot de zogenaamde Balmerserie (zie de onderstaande afbeelding).
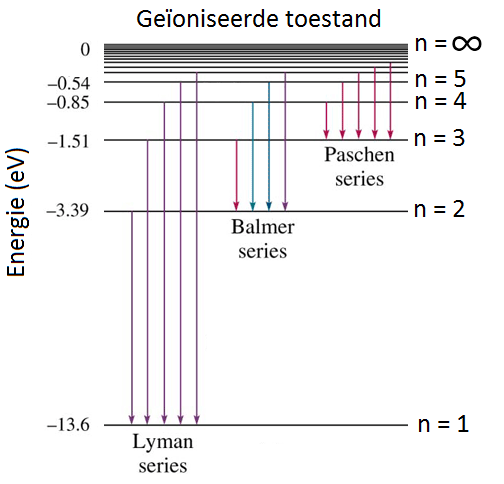
De eerste paar fotonen uit de balmerserie vallen in het zichtbare spectrum. Deze golflengten komen precies overeen met de spectraallijnen van waterstof. Niels Bohr was hiermee de eerste die de spectraallijnen kon verklaren.

Zowel in de formule als in het diagram zien we dat het elektron in zijn grondtoestand (n = 1) een energie heeft van -13,6 eV. Het elektron ontsnapt dus als het een foton absorbeert van boven de 13,6 eV. In dat geval zeggen we dat het waterstof atoom geïoniseerd is. De ionisatie- of uittree-energie van waterstof is dus gelijk aan 13,6 eV.
 Rekenen aan de energieniveaus van het waterstofatoom
Rekenen aan de energieniveaus van het waterstofatoom
|
|
In eerdere paragrafen hebben we gezien dat deeltjes zowel golf- als deeltjes eigenschappen hebben. In deze paragraaf gaan we dit beter begrijpen met behulp van de onzekerheidsrelatie van Heisenberg.
Als we de schuif meer naar rechts slepen, dan wordt de positie steeds beter te bepalen, maar nu wordt de golflengte onzeker. Een dergelijke golf is namelijk te maken door heel veel sinussen met verschillende golflengtes bij elkaar op te tellen. In de rechter afbeelding zijn de sinussen zichtbaar die hiervoor gebruikt zijn. We hebben hier dus niet te maken met één golflengte, maar met een hele serie.
Bij een deeltje moeten we dus een afweging maken tussen een zekere positie of een zekere golflengte. Beide grootheden kunnen echter niet tegelijk nauwkeurig kenbaar zijn. Omdat de golflengte gerelateerd is aan de impuls via de formule λ = h/p, kunnen we ook zeggen dat we of een zekere positie of een zekere impuls kunnen hebben. Dit idee wordt deonzekerheidsrelatie of ook wel de onbepaaldheidsrelatie van Heisenberg genoemd. Wiskundig wordt dit als volgt beschreven:
$$\Delta x \Delta p \geq \frac{h}{4\pi}$$
|
De 'delta's' staan in deze formule voor de onzekerheid. Als een deeltje zich bijvoorbeeld op een onbekende plek in een doosje van lengte L bevindt, dan is de onzekerheid in de plaats gelijk aan L. Als de snelheid van dit deeltje tussen de 20 en 25 m/s ligt, dan is de onzekerheid in de snelheid gelijk aan 25 - 20 = 5 m/s. Met de onzekerheid in de snelheid kan dan als volgt de onzekerheid in de impuls bepaald worden:
$$\Delta p = m \Delta v$$Belangrijk is te realiseren dat deze onzekerheid niet ontstaat omdat onze meetinstrumenten niet goed genoeg zijn, maar omdat deeltjes en golven tegenstrijdige kenmerken hebben die niet tegelijk kunnen bestaan. In het dagelijks leven merken we echter weinig van deze onzekerheid, omdat h erg klein is.
Omdat ook geldt dat p = h/λ, kunnen we de onzekerheid in de impuls ook schrijven als:
$$\Delta p = h \Delta \left(\frac{1}{\lambda}\right)$$Hoewel λ hier onder de deelstreep staat, betekent een grotere onzekere impuls natuurlijk niet een zekere λ. Een onzekere impuls levert natuurlijk ook een onzekere λ.
De onzekerheidsrelatie speelt o.a. een grote rol bij elektronen in atomen. Door de kleine massa van een elektron, is de onzekerheid in de impuls vrij klein en als gevolg is de onzekerheid in de positie relatief groot. Als gevolg is de kansgolf van het elektron vaak in dezelfde orde van grootte als het hele atoom. Als we over elektronen in atomen spreken, spreken we daarom vaak van een elektronenwolk. De atoomkern heeft relatief gezien een veel grotere massa en dus ook een grotere onzekerheid in de impuls. Als gevolg kan de onzekerheid in de positie veel kleiner zijn. De atoomkern heeft dus een veel duidelijker gespecificeerde positie.
We kunnen met de onzekerheidsrelatie ook begrijpen waarom elektronen nooit in de atoomkern vallen, terwijl ze wel elektrisch aangetrokken worden tot de kern. Als het elektron namelijk in de kern zou vallen, dan zou het een veel beter gedefinieerde positie hebben en dus een slecht gedefinieerde snelheid. Met zoveel variatie aan snelheid verspreid het elektron zich weer direct tot een wolk.
 Rekenen en redeneren met de onzekerheidsrelatie
Rekenen en redeneren met de onzekerheidsrelatie
|
|
Deeltjes in de kwantumfysica hebben nog een andere merkwaardige eigenschap. Ze kunnen door barrières heen dringen, waar ze volgens de wet van behoud van energie nooit doorheen zouden moeten kunnen komen. Dit proces wordt tunneling genoemd.
Stel dat we in de klassieke natuurkunde een deeltje over een heuvel willen rollen met een bepaalde beginsnelheid. Volgens de mechanica van Newton zal de bal alleen over de heuvel gaan als de kinetische energie gelijk of groter is dan de zwaarte-energie die de bal op de top zal hebben (we verwaarlozen de wrijvingskrachten). Als de kinetische energie niet voldoende is, dan zal de bal weer terugrollen. Deze situatie is linksonder geschetst. In de kwantumfysica bestaat er echter een kleine kans dat het deeltje toch door de barrière heen gaat. Dit is in de rechter afbeelding weergegeven. Dit effect wordt tunneling genoemd. Op macroscopisch niveau zien we tunneling eigenlijk zo goed als nooit gebeuren. Als de grootte van de kansgolf echter in de buurt begint te komen van de grootte van de barrière, dan begint dit effect merkbaar te worden.
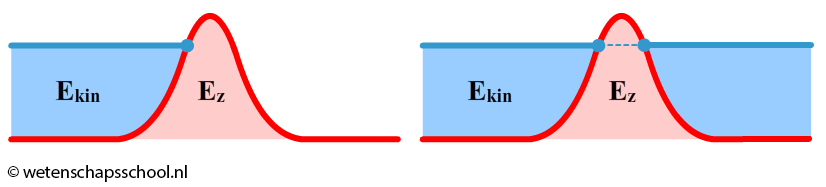
Het effect is te begrijpen met behulp van de onzekerheidsrelatie. Een onzekerheid in de snelheid zorgt voor een onzekerheid in de kinetische energie en deze onzekerheid zorgt ervoor dat tijdelijk even geen rekening gehouden hoeft te worden met behoud van energie - net lang genoeg om toch over de barrière te komen.
De kans op tunnelen hangt af van een aantal factoren. De kans op tunneling neemt toe als:
In het onderstaande programma kan je al deze eigenschappen aanpassen en kan je zien wat het effect is op tunneling.
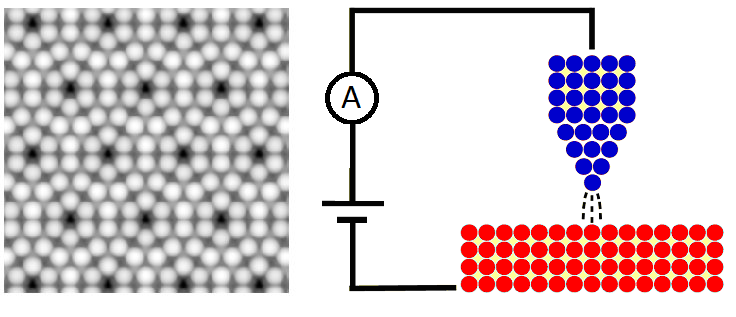
Een ander voorbeeld van een barrière is de elektrische barrière die een elektron ervaart in een atoom door de aantrekkingskracht van de protonen in de kern. Als we een elektron willen laten ontsnappen, dan moet de kinetische energie van dit elektron normaalgesproken groter of gelijk zijn aan de elektrische energie. In de kwantummechanica heeft het elektron echter ook een kleine kans om uit het atoom te tunnelen als er niet voldoende energie is. Hier wordt o.a. gebruik van gemaakt bij de scanning tunneling microscoop (STM). De microscoop bestaat uit een dunne naald die over een aantal atomen beweegt. Hoe dichter de naald bij een atoom komt, hoe kleiner de barrière tussen het elektron en de naald en hoe groter de kans is dat het elektron naar de naald tunnelt. Deze tunnelende elektronen zorgen voor een meetbaar stroompje. Hoe groter deze stroom is, hoe dichter het atoom zich bij de naald bevindt. Door de naald over de atomen te trekken, dan zo een beeld worden gemaakt van de atomen.
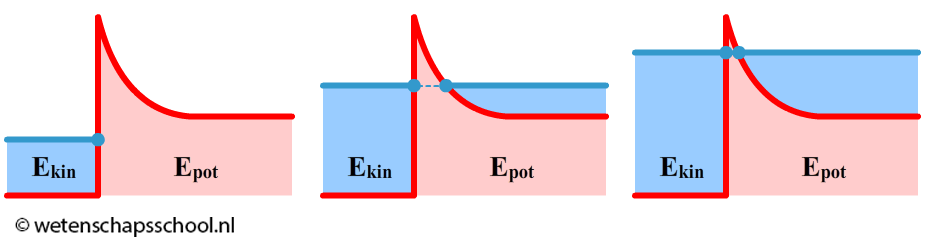
Een ander voorbeeld van tunneling is alfastraling. Bij dit proces tunnelt een heliumkern (twee protonen en twee neutronen) uit een atoomkern. De deeltjes in de kern worden normaalgesproken goed bij elkaar gehouden door de zogenaamde kernkracht. In de kwantummechanica hebben deze deeltjes echter een kans door deze kernkracht-barrière heen te tunnelen. Hieronder zien we het bijbehorende energiediagrammen van dit proces. In de linker afbeelding heeft het deeltje niet genoeg energie om door de barrière heen te kunnen. In het middelste voorbeeld wel. In de rechter voorbeeld gaat het tunnelen nog een stuk gemakkelijker. Niet alleen heeft het deeltje hier meer energie, maar ook de barrière is hier dunner.
Ook bij kernfusie speelt tunneling een grote rol. In het binnenste van de zon worden waterstofatomen gefuseerd tot heliumatomen. De protonen in beide waterstofatomen moeten hiervoor enorm dicht bij elkaar gedrukt worden. Hier is veel kracht voor nodig, omdat protonen elkaar elektrisch afstoten. Volgens de newtoniaanse mechanica zou zelfs in het centrum van de zon de kracht niet groot genoeg zijn om dit voor elkaar te krijgen. Toch kan fusie plaatsvinden, omdat de protonen af en toe wel door tunneling samenkomen. Bij deze fusie komt het zonlicht vrij dat wij dagelijks waarnemen. Zonder tunneling zou de zon dus geen licht geven!
 Redeneren met tunneling
Redeneren met tunneling
|
|
| BINAS: | |
| 5 | Elektronvolt |
| 7 | Constante van Planck, elektronlading, lichtsnelheid en massa elektron |
| 21 | Energieniveaus waterstof |
| 24 | Foto-elektrisch effect (uittree-energie, grensfrequentie en grensgolflengte) |