Ook atomen zijn weer opgebouwd uit kleinere deeltjes. Elk atoom heeft in zijn centrum een atoomkern, bestaande uit positief geladen deeltjes die we protonen noemen en neutraal geladen deeltjes die we neutronen noemen. Om de kern heen bevindt zich een wolk van negatieve deeltjes die elektronen worden genoemd. Elk atoom bevat evenveel protonen als elektronen en dit zorgt ervoor dat het atoom in zijn geheel neutraal is.
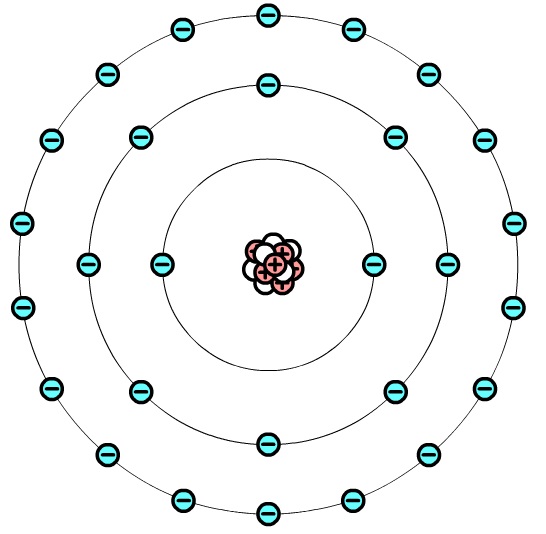
Zoals je in de afbeelding kunt zien, bewegen de elektronen zich niet willekeurig om de atoomkern. De elektronen bevinden zich op vaste afstanden van de kern. Deze vaste afstanden noemen we schillen. In de binnenste schil passen slechts twee elektronen, in de tweede schil passen 8 elektronen en in de derde schil passen wel 18 elektronen. Het zwaarste atoom dat we kennen heeft wel zeven schillen bestaande uit 118 elektronen.
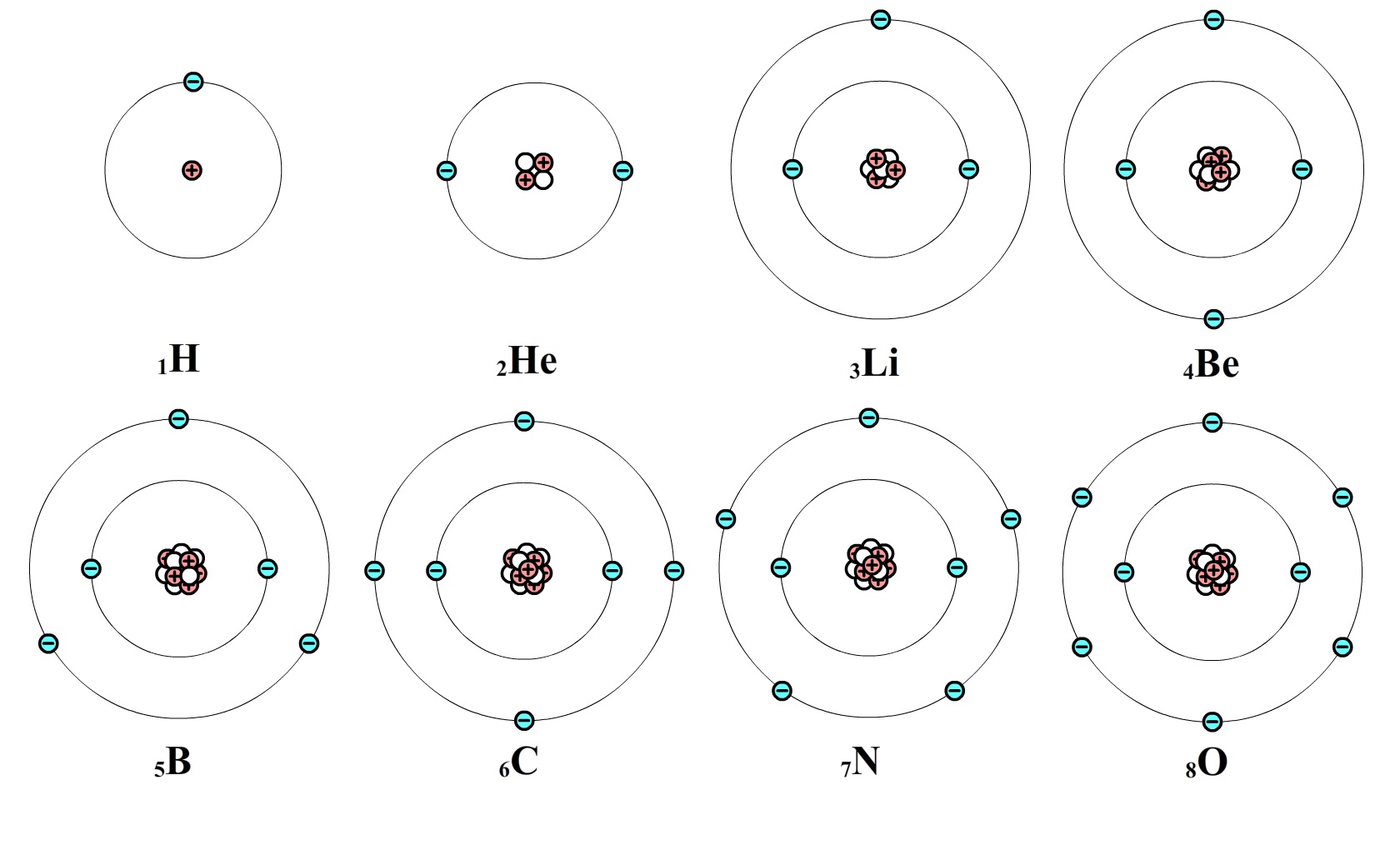
Hieronder zien we de eerste 8 atomen uit het periodiek systeem. Waterstof bestaat uit één proton en dus ook één elektron. Helium bestaat uit twee protonen en dus ook twee elektronen. Lithium bevat drie protonen en dus ook drie elektronen, maar omdat de eerste schil vol is, komt het derde elektron in de tweede schil terecht. Op deze manier zijn alle atomen uit het periodiek systeem opgebouwd.
Het aantal protonen in een atoom noemen we het atoomnummer. Elke atoomsoort heeft zijn eigen vaste atoomnummer. In het onderstaande periodiek systeem vind je het atoomnummer linksonder de symbolen.
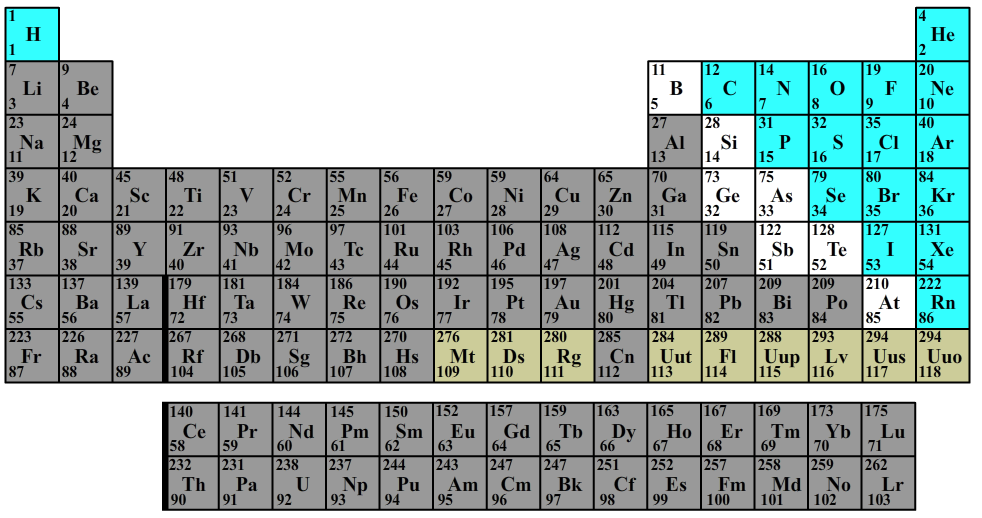
Het aantal protonen en neutronen samen noemen we het massagetal. In het onderstaande periodiek systeem kunnen we het massagetal linksboven de symbolen vinden. Fluor bevat bijvoorbeeld een atoomnummer van 9 en bevat dus altijd 9 protonen. Fluor heeft een massagetal van 19 en dat betekent dus dat fluor 10 neutronen bevat (omdat 9 + 10 = 19). Waterstof heeft een atoomnummer van 1 en bevat dus slechts 1 proton. Het massagetal van waterstof is ook 1, dus waterstof bevat 0 neutronen.
- Zorg dat je weet dat een atoom is opgebouwd uit evenveel protonen (positieve lading) en elektronen (negatieve lading).
- Zorg dat je weet dat elke atoomsoort zijn eigen atoomnummer heeft. Het atoomnummer staat voor het aantal protonen in de kern.
- Het massagetal staat voor het aantal protonen en neutronen samen.
- Zorg dat je het atoomnummer en het massagetal in het periodiek systeem kan opzoeken.
- Alledaagse voorwerpen als stoelen en tafels bestaan dus uit geladen deeltjes zoals protonen en elektronen. Hoe komt het dat we hier in de praktijk niks van merken?
- Een atoom bevat 16 protonen. Om welk soort atoom gaat het hier?
-
Een atoom bevat 79 protonen.
- Hoeveel elektronen bevat dit atoom? Leg je keuze uit.
- Welke atoomsoort is dit?
-
- Welk atoomnummer heeft magnesium?
- Teken een magnesium atoom. Geef hierin duidelijk de protonen en elektronen weer.
-
Reken bij de volgende atomen uit hoeveel protonen
en hoeveel neutronen er in de atoomkern zitten:
- Helium
- Koolstof
- IJzer
- Waterstof
- Hoeveel protonen en hoeveel neutronen bevat één watermolecuul?
- Start achter in je schrift een learning log. Dit is een deel van je schrift waar je de belangrijkste dingen opschrijft die je geleerd hebt. Schrijf hier vooral de kennis op die je nodig had bij het beantwoorden van de vragen. Denk bijvoorbeeld aan de momenten waar je dacht 'oh, nu snap ik het!'. Op deze manier ga je veel beter onthouden wat je geleerd hebt, zodat je het niet weer helemaal overnieuw hoeft te leren als je voor de toets gaat leren. Zo heb je ook nog wat aan het werk dat je in de les doet.